مثال على قانون تشارلز
الفيزياء / / November 13, 2021
قانون الغاز الخاص بتشارلز أو قانون الضغط المستمر هو أحد قوانين الغاز الأخرى ، أعلنها جاي لوساك ، الذي أصدر أعمال جاك تشارلز ، التي نُشرت حوالي 20 قبل سنوات.
يتنبأ قانون تشارلز بسلوك كتلة الغاز عندما يظل الضغط ثابتًا وتختلف درجة الحرارة والحجم.
ينص قانون تشارلز على النحو التالي:
عند الضغط المستمر ، يتناسب حجم الغاز طرديًا مع التغير في درجة حرارته.
ضغط مستمر: يشير إلى حقيقة أن الضغط الذي يمارسه الغاز على جدران الحاوية لن يتغير طوال التجربة.
مقدار: هي الحيز المشغول الذي يشغله الغاز وبصورة عامة هو عبارة عن حاوية ذات جدران غير مشوهة ويعمل غطاؤها كغطاس.
درجة حرارة: زيادة أو فقد الحرارة التي يتعرض لها الغاز أثناء التجربة. إذا زادت درجة الحرارة ، يزداد الصوت. إذا انخفضت درجة الحرارة ، ينخفض الحجم أيضًا.
جبريًا ، يتم التعبير عن قانون تشارلز بالصيغة التالية:

أين:
V = حجم الغاز
T = درجة حرارة الغاز
k = ثابت التناسب لتلك الكتلة من الغاز.
هذا يعني أنه بالنسبة لكتلة معينة من الغاز ، عند ضغط ثابت ، فإن العلاقة بين الحجم و تغيرات درجة الحرارة ، سيكون لها دائمًا نفس علاقة التناسب ، ممثلة بالثابت ك:

لذلك بمجرد تحديد الثابت ، يمكننا حساب أي من القيم الأخرى من البيانات المعروفة الأخرى:
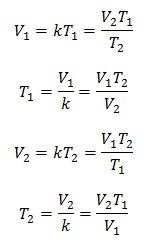
3 أمثلة على قانون تشارلز المطبق على المشاكل:
مثال 1: احسب الحجم الجديد ، إذا كانت هناك كتلة غاز في حاوية تشغل حجمًا 1.3 لترًا ، عند درجة حرارة 280 كلفن. احسب الحجم عند الوصول إلى درجة حرارة 303 كلفن.
الخامس1 = 1.3 لتر.
تي1 = 280 ك
الخامس2 = ?
تي2 = 303 ك
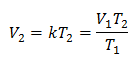
استبدال القيم:
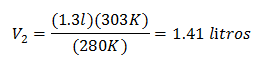
الحجم الجديد عند 303 كلفن 1.41 لتر.
مثال 2. إذا كان لدينا غاز يشغل 2.4 لترًا عند 10 درجات مئوية ، احسب درجة الحرارة النهائية ، إذا احتل في النهاية 2.15 لترًا.
الخامس1 = 2.4 لتر
تي1 = 10 درجة مئوية = 283 كلفن
الخامس2 = 2.15 لتر
تي2 = ?
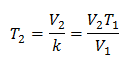
استبدال القيم:
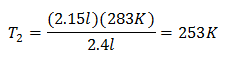
درجة الحرارة الجديدة 253 كلفن أي ما يعادل -20 درجة مئوية.
مثال 3. لدينا غاز درجة حرارته الابتدائية 328 كلفن ، وحجمه النهائي 3.75 لترًا ، وثابت نسبته 0.00885.
الخامس1 = ?
تي1 = 328 ك
الخامس2 = 3.75 لتر
تي2 = ?
ك = 0.00885
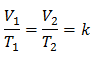
استبدال القيم:
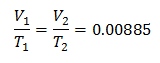
لمعرفة الحجم الأولي:
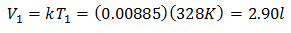
الحجم الأولي 2.90 لتر.
لمعرفة درجة الحرارة النهائية:
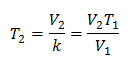
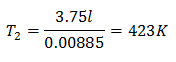
ستكون درجة الحرارة النهائية 423 كلفن ، أي ما يعادل 150 درجة مئوية.