30 أمثلة على الألدهيدات
أمثلة / / November 06, 2023
ال الألدهيدات نكون مركبات العضوية والتي تتكون من سلسلة كربون تحتوي على مجموعة كربونيل طرفية (= C = O) متصلة (تقع في أحد طرفي السلسلة) مركب) والتي بدورها ترتبط بذرة الهيدروجين.
الألدهيدات الشائعة جدًا هي الميثانال (الفورمالدهيد)، والإيثانال (الأسيتالديهيد)، والبروبانال (البروبالدهيد).

بعض هذه المركبات موجودة في الطبيعة، على سبيل المثال، الفانيلين أو الفانيلين هو ألدهيد طبيعي يشكل النكهة الرئيسية للفانيليا.
- أنظر أيضا: الألدهيدات والكيتونات
تسمية الألدهيدات
يمكن تسمية الألدهيدات باستخدام قواعد التسمية التي وضعها الاتحاد الدولي للكيمياء البحتة والتطبيقية (IUPAC).
لتسمية الألدهيد، يتم استخدام البادئات التي تشير إلى عدد ذرات الكربون التي ربطتها سلسلة الكربون بمجموعة الكربونيل. توجد مجموعة الكربونيل دائمًا في أحد طرفي سلسلة الكربون، مما يعني أنها ستحتل دائمًا الموضع الأول وليس من الضروري الإشارة إلى موقعها في السلسلة. بالإضافة إلى ذلك، يتم وضع اللاحقة -al في نهاية اسم الألدهيد. بعض الأمثلة هي:
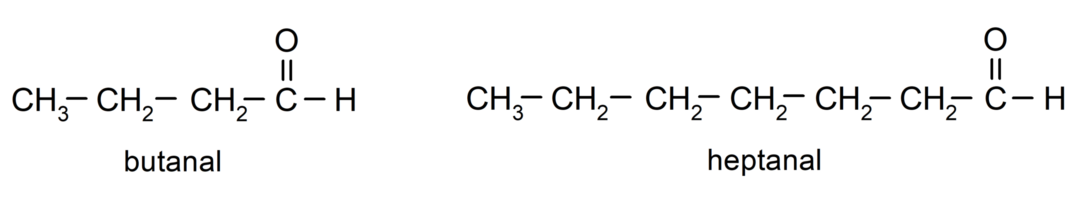
إذا كان الألدهيد متفرعا، أي أنه يتكون من عدة سلاسل كربون، فإن السلسلة الرئيسية هي السلسلة التي تحتوي على أكبر عدد من ذرات الكربون، والتي تحتوي أيضًا على المجموعة الكربونيل. تتم تسمية بقية السلاسل كمجموعات بديلة.
علاوة على ذلك، يجب اختيار كل مجموعة بديلة بحيث يحتل موقعها أقل ترقيم ممكن في سلسلة الكربون الرئيسية. ومن ناحية أخرى، يبدأ عد ذرات الكربون في السلسلة الرئيسية عند النهاية التي تحتوي على مجموعة الكربونيل. بعض الأمثلة هي:
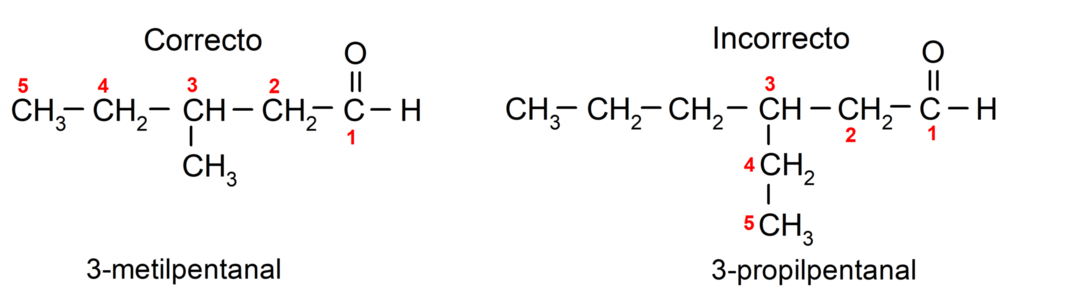
إذا كان الألدهيد يعمل كبديل في الجزيء، لأنه يتكون أيضًا من مجموعات وظائف ذات أولوية أعلى، مثل الأحماض والاسترات، ثم تتم تسمية مجموعة الألدهيد -أوكسو. على سبيل المثال:

إذا كان الألدهيد يحتوي على عدة مجموعات كربونيل، فإنه يتم تسميته باستخدام البادئات التي تشير إلى عدد هذه المجموعات، والاتصال (مجموعتين من الكربونيل)، والتجربة (ثلاث مجموعات كربونيل)، وما إلى ذلك. على سبيل المثال:
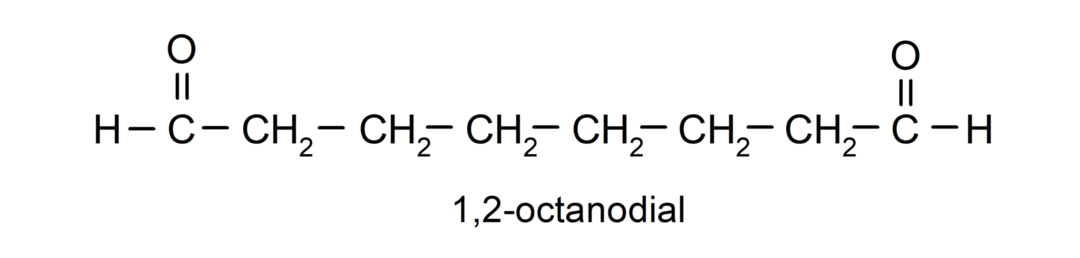
عندما ترتبط مجموعة الكربونيل بدورة، تتم تسمية الألدهيدات باستخدام مصطلح كاربالديهيد. على سبيل المثال:

الخصائص الفيزيائية للألدهيدات
عادة ما يكون للألدهيدات بعض الاختلاف في نفس الخاصية الفيزيائية. يحدث هذا لأن الخواص الفيزيائية للألدهيدات تعتمد على كيفية تكوين سلسلة الكربون المرتبطة بمجموعة الكربونيل.
بعض الخصائص الفيزيائية للألدهيدات هي:
- الذوبان. تعتمد قابلية ذوبان الألدهيدات في الماء على كمية الذرات الذي يحتوي على سلسلة الكربون. الألدهيدات ذات سلاسل الكربون الأقصر (تصل إلى حوالي خمس ذرات كربون) قابلة للذوبان في الماء. الألدهيدات التي تحتوي على سلاسل كربونية مكونة من العديد من ذرات الكربون غير قابلة للذوبان في الماء. الميثانال والإيثانال قابلان للذوبان بشدة في الماء.
- كثافة. بشكل عام، الألدهيدات هي مركبات أقل كثافة من الماء.
- دول التجميع. الألدهيدات تتكون من ذرة وذرتين كربون غازات، تلك التي تحتوي على ما بين ثلاث إلى اثني عشر ذرة كربون هي السوائلوتلك التي تتكون من أكثر من اثنتي عشرة ذرة كربون تكون صلبة.
- يشم. بعض الألدهيدات لها روائح مزعجة، والبعض الآخر لها روائح طيبة.
- قطبية. مجموعة الكربونيل تعطيهم قطبية.
- نقطة الغليان. لديهم نقاط غليان أعلى من الألكانات ذات الوزن الجزيئي المماثل، ولها نقاط غليان أقل من الأحماض الكربوكسيلية والكحولات ذات الوزن الجزيئي المماثل.
الخواص الكيميائية للألدهيدات
بعض الخواص الكيميائية للألدهيدات هي:
تتأكسد الألدهيدات عندما تتفاعل مع كواشف تولنز وبندكت وفيلينج. لتكوين الحمض الكربوكسيلي المقابل. سيكون للحمض المتكون نفس عدد ذرات الكربون في سلسلة الكربون مثل الألدهيد الذي تشكل منه. على سبيل المثال:
- الأكسدة باستخدام كاشف تولنس (مركب الفضة الأمونيا في المحلول الأساسي، [Ag (NH3)2]+). ينتج عن هذا التفاعل الحمض المقابل والفضة المعدنية.

- الأكسدة بكاشف بنديكت وفيلينج (المحاليل القلوية لكبريتات النحاس (II) (CuSO4) بتراكيب مختلفة). ينتج عن هذا التفاعل الحمض المقابل وأكسيد النحاس (Cu2أيضاً).

أنها تخضع لتفاعلات الإضافة النوويةحيث يتم إضافة النيوكليوفيلات إلى مجموعة الكربونيل من الألدهيدات. بعض الأمثلة هي:
- تفاعلات الإضافة الكحوليات إلى مجموعة الكربونيل من الألدهيدات لتكوين الأسيتال والنصف الأسيتال.
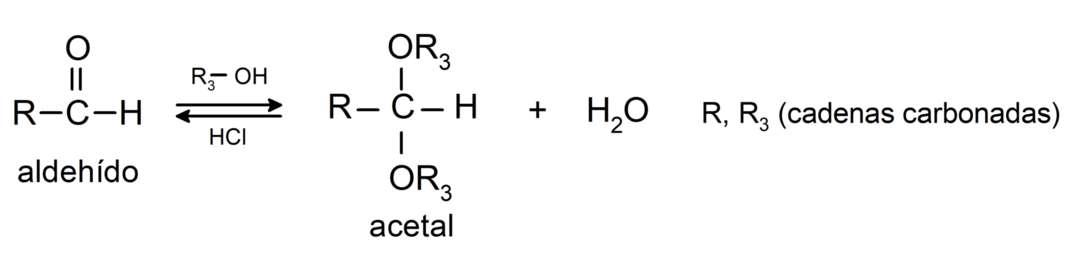
- تفاعلات الإضافة الأمينات الأساسي لمجموعة الكربونيل.

- تفاعلات إضافة حمض الهيدروسيانيك (HCN)، حيث يتم تشكيل السيانوهيدرين أو السيانوهيدرين.

أنها تخضع لتفاعلات تكثيف ألدول. في هذا النوع من التفاعل، يتكثف اثنان من الألدهيدات لتكوين ألدول. وهي تفاعلات تحدث مع هيدروكسيد الصوديوم (NaOH). على سبيل المثال:
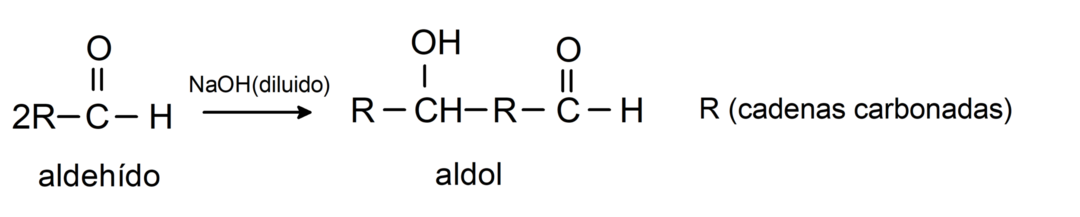
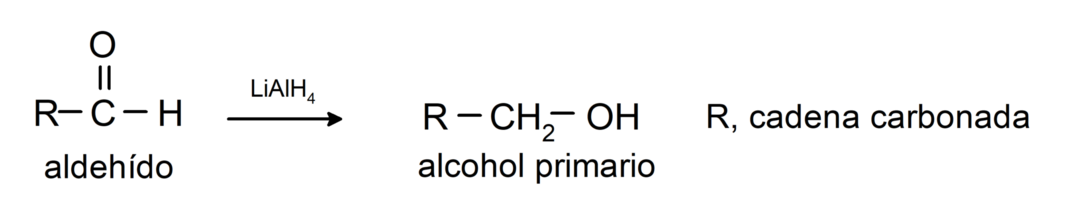
أنها تخضع لتفاعلات الاختزال للكحولات الأولية. في وجود بوروهيدريد الصوديوم (NaBH4) وهيدريد ألومنيوم الليثيوم (LiAlH4) أو عن طريق الهدرجة الحفزية، يتم اختزالها إلى كحولات أولية. على سبيل المثال:
أمثلة على الألدهيدات
- الميثانال (الفورمالدهيد)
- إيثانال (أسيتالديهيد)
- بروبانال (بروبالديهيد)
- بوتانال
- خماسي
- فانيلين
- سينامالديهيد
- بروبينال
- البنزالديهايد
- سداسي
- 3-بروموسيكلوبنتين كاربالديهيد
- سيكلوهكسان كاربالديهيد
- 4,4-ثنائي ميثيل بنتانال
- 2-هيدروكسي بيوتانال
- 2-هيدروكسي-2-ميثيل-بيوتانال
- 2،3-ثنائي ميثيل بنتانال
- خماسي
- سيكلوبنتان كاربالديهيد
- إيزوبوتانال
- 2- كلورو بيوتانال

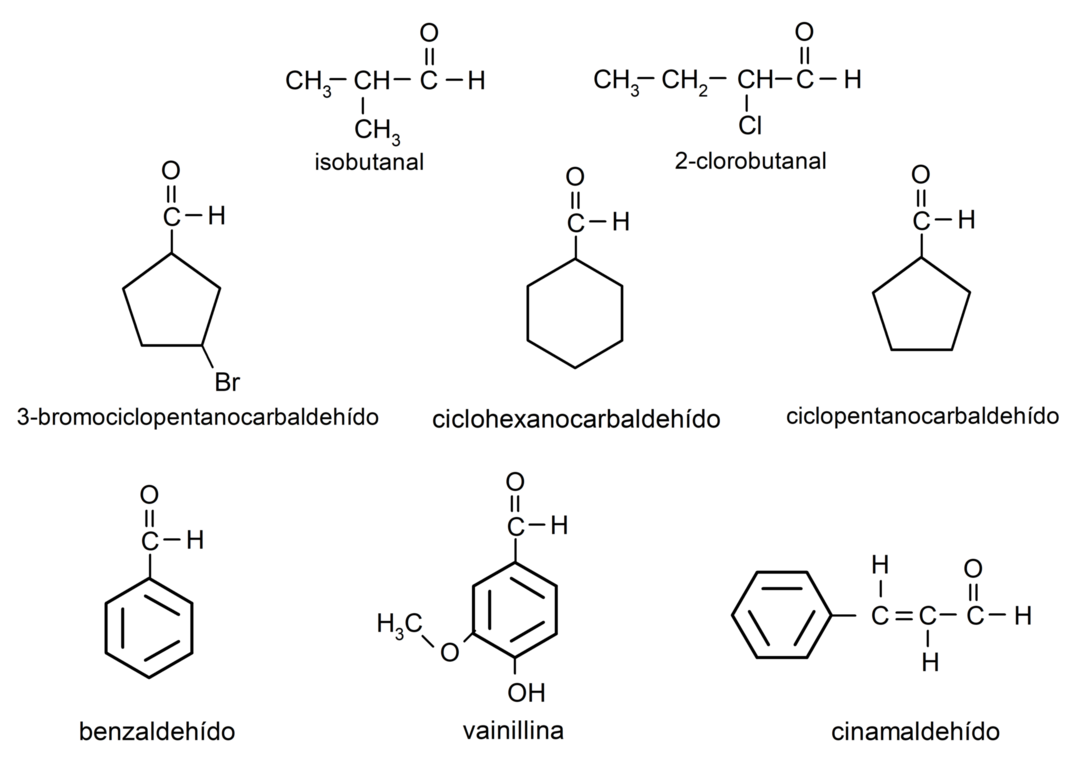
الألدهيدات في الطبيعة
بعض الألدهيدات الموجودة في الطبيعة هي:
- البنزالديهايد، أحد مكونات اللوز.
- سينمالدهيد، المكون الذي يعطي خلاصة القرفة رائحتها.
- الفانيلين، وهو العنصر الذي يعطي الفانيليا نكهتها.
ومن ناحية أخرى، فإن أحد أشكال الجلوكوز، وهو الشكل المفتوح، يحتوي على مجموعة ألدهيد وظيفية.
يُعتقد أن الأسيتالديهيد، الذي يتكون كوسيط في استقلاب الكحول، يسبب أعراض الخمار عند التسمم بالكحول.
استخدامات الألدهيدات
بعض الاستخدامات الرئيسية للألدهيدات هي:
- يتم استخدامها في إنتاج المذيبات والدهانات ومستحضرات التجميل والجواهر.
- يتم استخدامها في صناعة الراتنجات. يتكون الباكليت من الفورمالديهايد وهو راتينج يعمل بشكل جيد كعازل كهربائي.
- لقد تم استخدامها كمهدئات. تم استخدام البارا ألدهيد كمسكن ومنوم، على الرغم من أنه لم يعد صالحًا للاستخدام الآن بسبب رائحته الكريهة.
- يتم استخدامها كمواد حافظة للعينات البيولوجية والجثث. يستخدم الفورمالديهايد على نطاق واسع في هذا المعنى.
- يتم استخدامها كمنكهات غذائية. ومن الأمثلة على ذلك الفانيلين، الذي يستخدم لإعطاء الحلويات رائحة الفانيليا.
- يتم استخدامها كعوامل مطهرة.
مخاطر الألدهيدات
تم اعتبار العديد من الألدهيدات مسرطنة، على سبيل المثال، تم إعلان الفورمالديهايد مركبًا مسرطنًا وفقًا لمنظمة الصحة العالمية (منظمة الصحة العالمية).
التعرض والاتصال مع العديد من الألدهيدات يسبب تهيج الجلد والعينين والجهاز التنفسي. ومن ناحية أخرى، فإنه يسبب التهاب الجلد التماسي وأمراض الكبد.
مراجع
- سولومونز، ت.و. جراهام وماريا كريستينا سانجينيس فرانشيني (1985). “الكيمياء العضوية" المكسيك، دي إف: ليموسا.
- ويتن، ك. دبليو، جيلي، ك. د، ديفيس، ر. إي، دي ساندوفال، م. ت. ل. أو، و موراداس، آر. م. ز. (1992). “كيمياء عامة" (ص. 108-117). ماكجرو هيل.
- أرتيجا، P. م. (2017). “الكيتونات والألدهيدات" نشرة كون-علم علمية للمرحلة الإعدادية عدد 3، 4(8).
اتبع مع:
- السكريات
- هيدراسيدس
- الكحول الإيثيلي
- المركبات العضوية وغير العضوية
