30 أمثلة على الكحول
أمثلة / / November 06, 2023
ال الكحوليات نكون المركبات الكيميائية العضوية تحتوي في بنيتها على مجموعة الهيدروكسيل الوظيفية (- OH) المرتبطة بذرة الكربون (- C). المجموعة (- C - OH) تسمى "الكاربينول". بعض الأمثلة على الكحول هي: الميثانول والإيثانول و1-بروبانول.
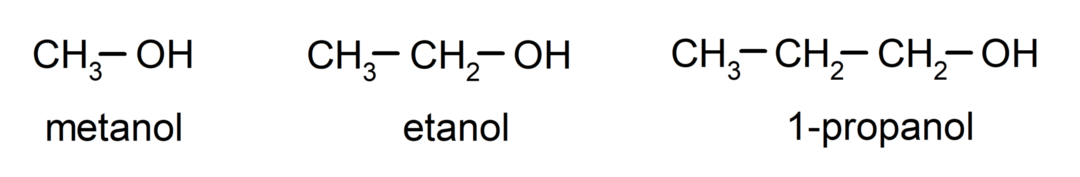
الكحوليات هي مركبات كيميائية لها استخدامات مختلفة في الحياة اليومية، حيث أنها تمتلك خصائص مضادة للجراثيم ومطهرة. ومن ناحية أخرى، يمكن أن تكون خطرة على صحة الإنسان عند تناولها دون مراقبة.
وبالمثل، لا يمكن للبشر تناول جميع أنواع الكحول.
- أنظر أيضا: الأمينات والكيتونات
أنواع الكحولات
اعتمادا على عدد ذرات الكربون التي ترتبط بها ذرة الكربون التي ترتبط بها مجموعة الهيدروكسيل، يمكن أن يكون الكحول:
- الكحول الأولي. ترتبط ذرة الكربون المرتبطة بمجموعة الهيدروكسيل أيضًا بذرة كربون واحدة. على سبيل المثال:
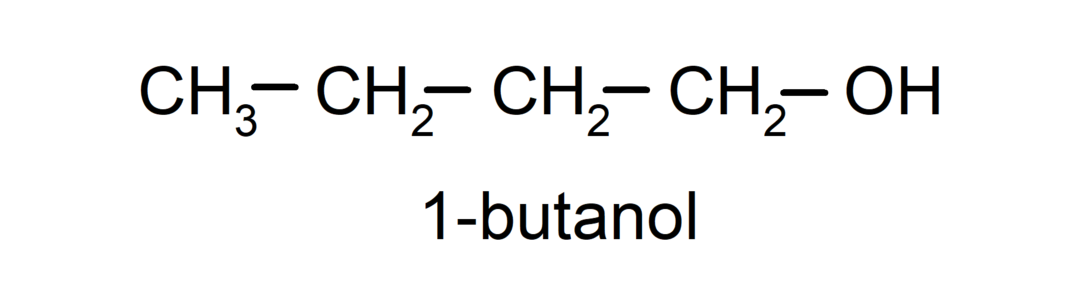
- الكحول الثانوي. ترتبط ذرة الكربون المرتبطة بمجموعة الهيدروكسيل أيضًا بذرتي كربون أخريين. على سبيل المثال:
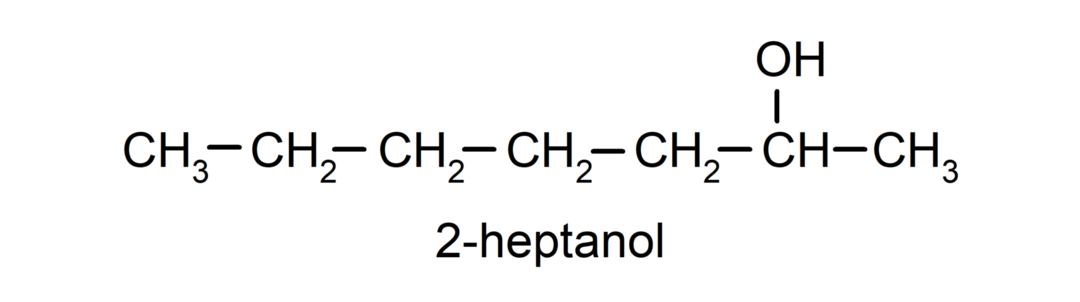
- الكحول الثلاثي. ترتبط ذرة الكربون التي ترتبط بها مجموعة الهيدروكسيل أيضًا بثلاث ذرات كربون. على سبيل المثال:
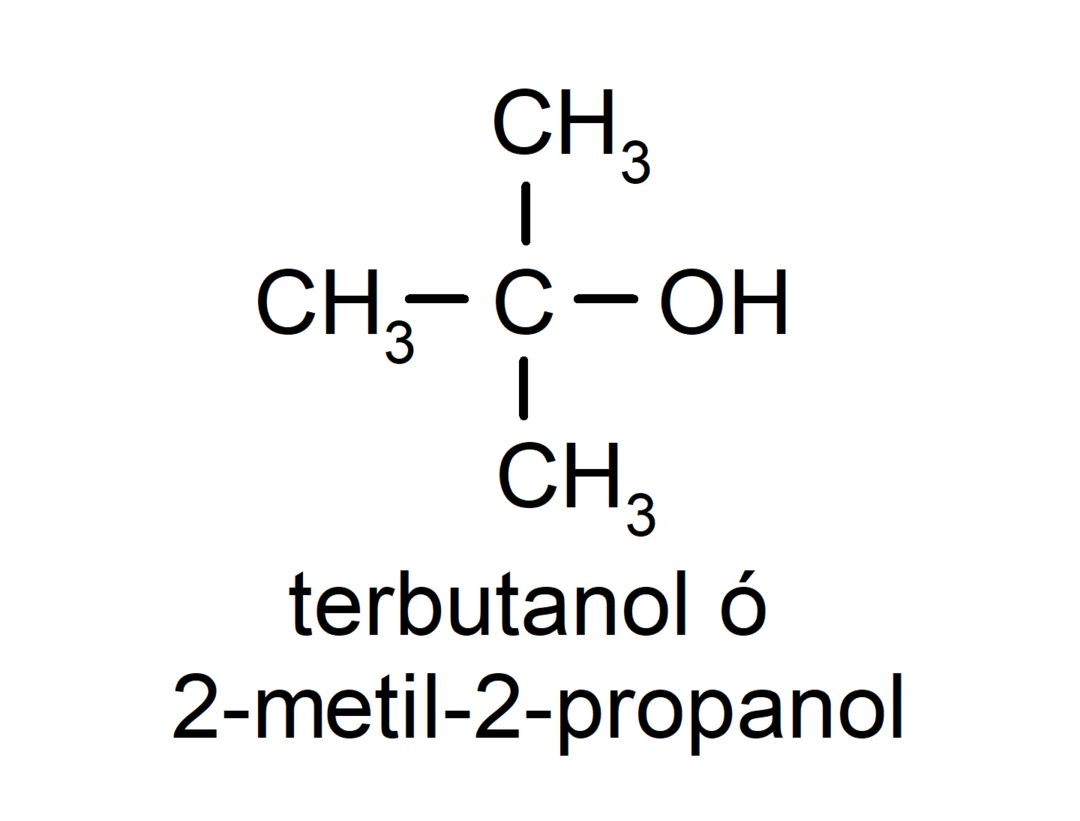
اعتمادًا على عدد مجموعات الهيدروكسيل الموجودة فيه، يمكن أن يكون الكحول:
- ديول. لديها مجموعتين الهيدروكسيل في هيكلها. على سبيل المثال:
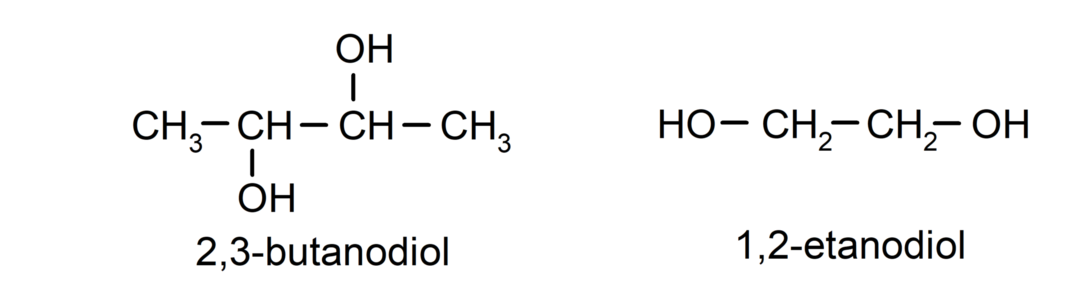
- تريول. لديها ثلاث مجموعات الهيدروكسيل في هيكلها. على سبيل المثال:
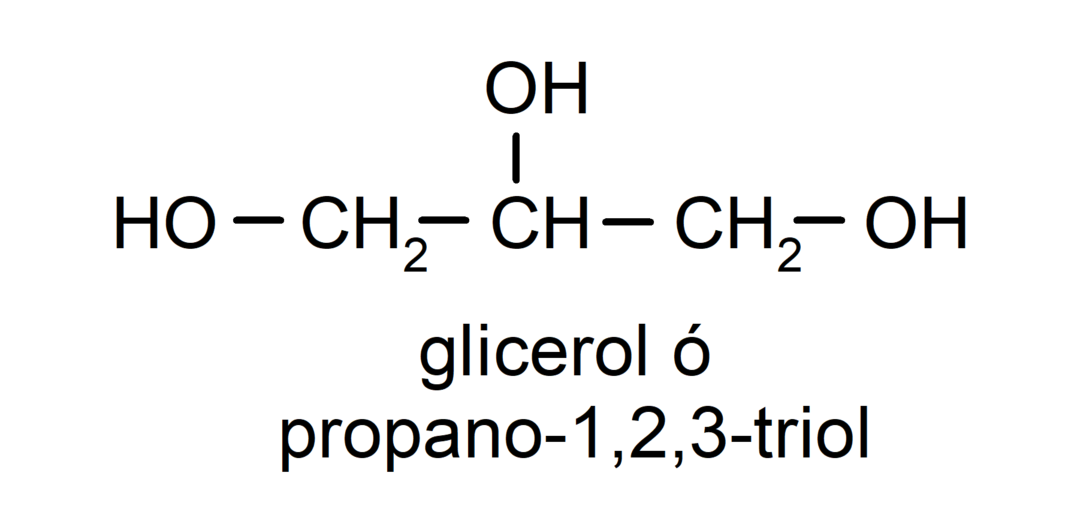
- متعدد الكحول. لديها العديد من مجموعات الهيدروكسيل في هيكلها. على سبيل المثال:
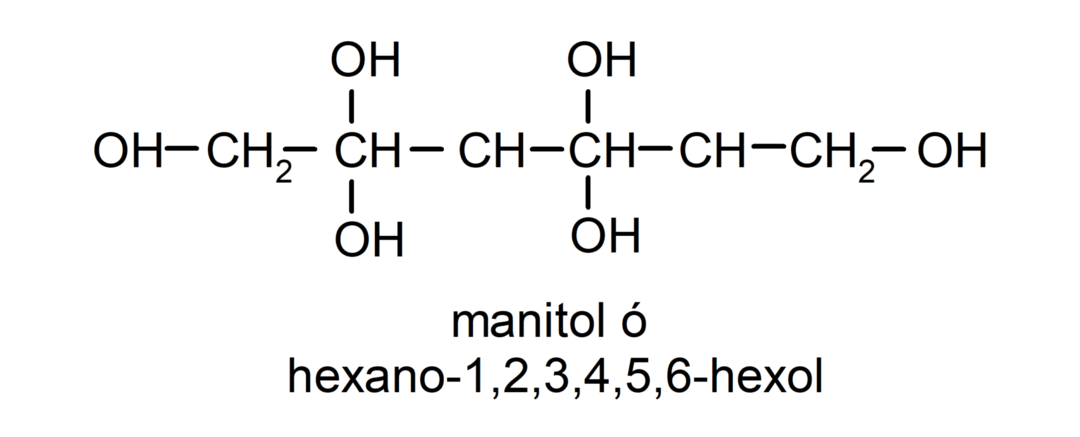
الخصائص الفيزيائية للكحولات
بعض الخصائص الفيزيائية للكحولات هي:
- نقطة الغليان. درجة غليان الكحوليات عالية جدًا بسبب وجود مجموعة الهيدروكسيل التي تسمح بتكوين روابط هيدروجينية. علاوة على ذلك، كلما زاد عدد مجموعات الهيدروكسيل الوظيفية الموجودة في سلسلة الكربون، كلما زاد عددها نقطة الغليان من الكحوليات.
- قطبية. الكحولات مركبات قطبية تمامًا.
- الذوبان. الكحولات منخفضة الوزن الجزيئي قابلة للذوبان في الماء. من ناحية أخرى، كلما كانت السلسلة الكربونية للكحوليات أكبر، قلت قابلية ذوبانها في الماء. بالإضافة إلى ذلك، كلما زادت مجموعات الهيدروكسيل في الكحولات، زادت قابليتها للذوبان في الماء.
- حالة التجميع. معظم الكحوليات تكون سائلة عند درجة حرارة الغرفة (25 درجة مئوية) ولها روائح مميزة.
الخواص الكيميائية للكحولات
بعض الخواص الكيميائية للكحولات هي:
- تتصرف الكحوليات مثل الأحماض والقواعد.. ويمكن رؤية سلوكها كأحماض في التفاعلات مع المعادن النشطة لإطلاق غاز الهيدروجين وتكوين ألكوكسيدات.

يمكن رؤية سلوكها كقواعد في تفاعلات مثل تفاعل الميثانول مع بروميد الهيدروجين لتكوين بروميد الميثيلوكسونيوم.
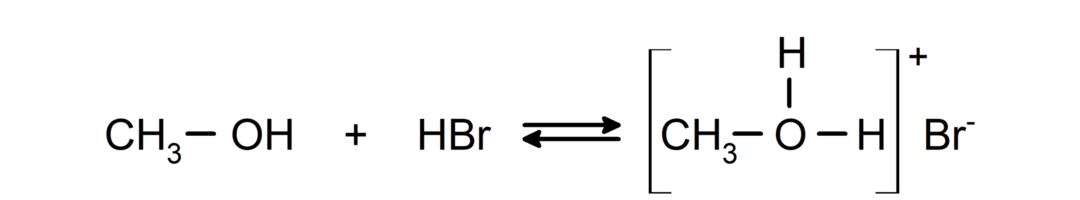
- تخضع الكحوليات لتفاعلات الهالوجين. تتفاعل مع هاليدات الهيدروجين لتكوين هاليدات الألكيل.
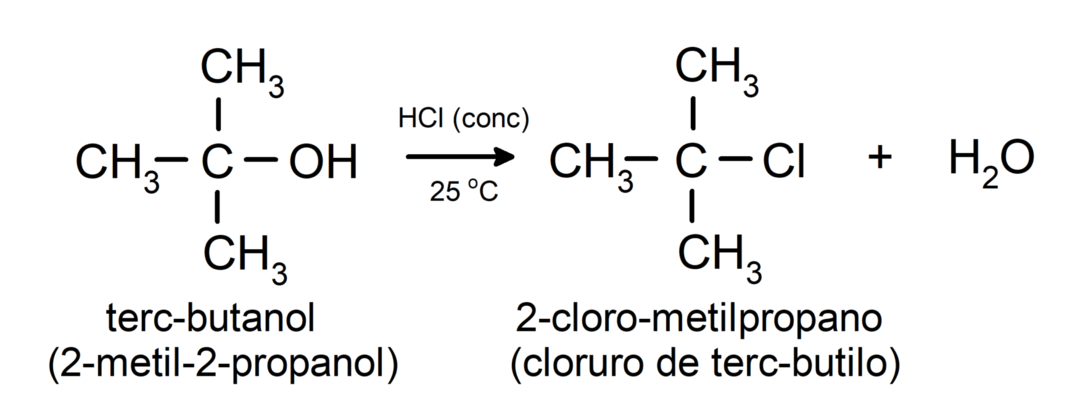
-
تخضع الكحوليات لتفاعلات الأكسدة عندما تتفاعل مع بعض المركبات المؤكسدة. تعتمد نواتج تفاعلات الأكسدة على نوع تفاعل الكحول، أي هل هو أولي أم ثانوي أم ثالثي.
أكسدة الكحول الأولي لتكوين ألدهيد أو حمض كربوكسيلي.
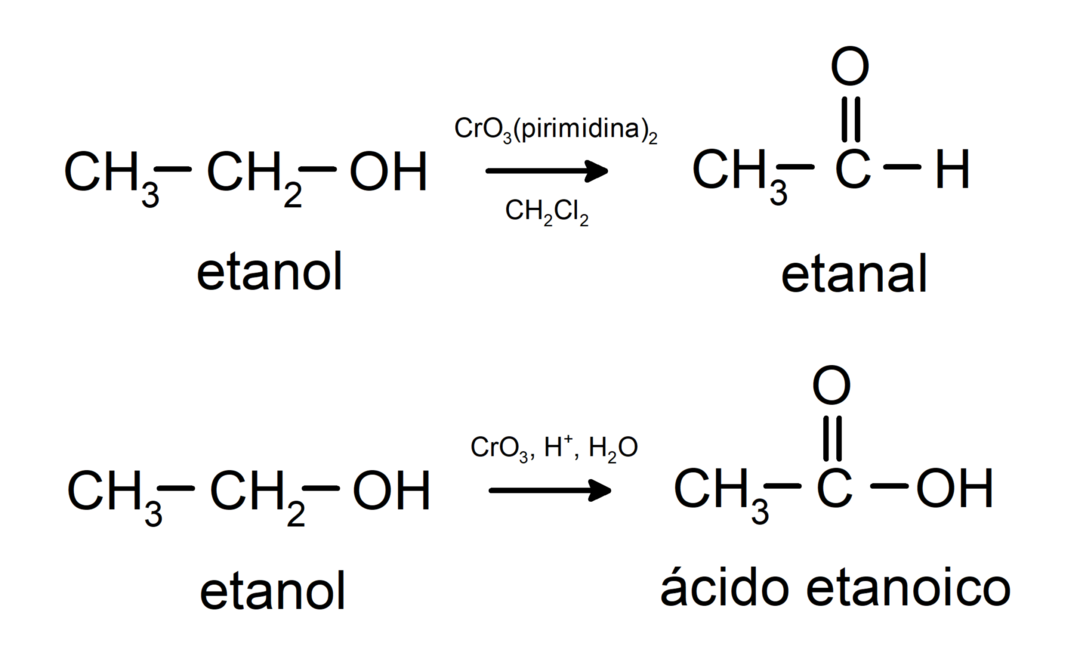
أكسدة الكحول الثانوي لتكوين الكيتون.
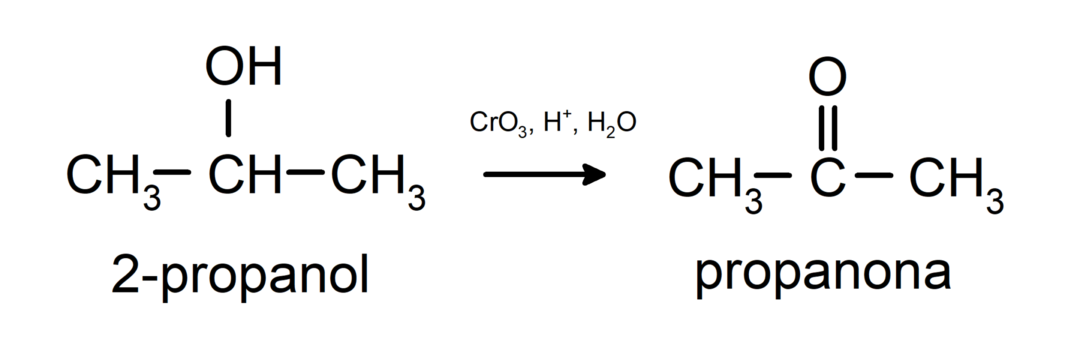
لا تتأكسد الكحولات الثلاثية مع المؤكسدات الشائعة. وباستخدام عوامل مؤكسدة قوية جدًا، يمكن تحويلها إلى ألكينات، والتي يمكن بعد ذلك أكسدتها.
تتأكسد الكحولات التي تحتوي على مجموعتي هيدروكسيل تقع على ذرات الكربون المجاورة مع رباعي أسيتات الرصاص لتكوين اثنين من الكيتونات.
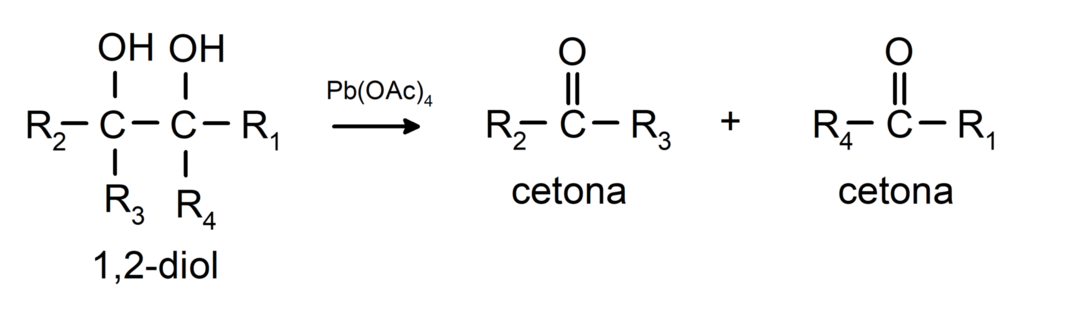
- تخضع الكحوليات لتفاعلات نزع الهيدروجين. تحدث هذه التفاعلات فقط مع الكحولات الأولية والثانوية، والتي عند تعرضها لدرجات حرارة عالية في وجود المحفزات، تطلق الهيدروجين.
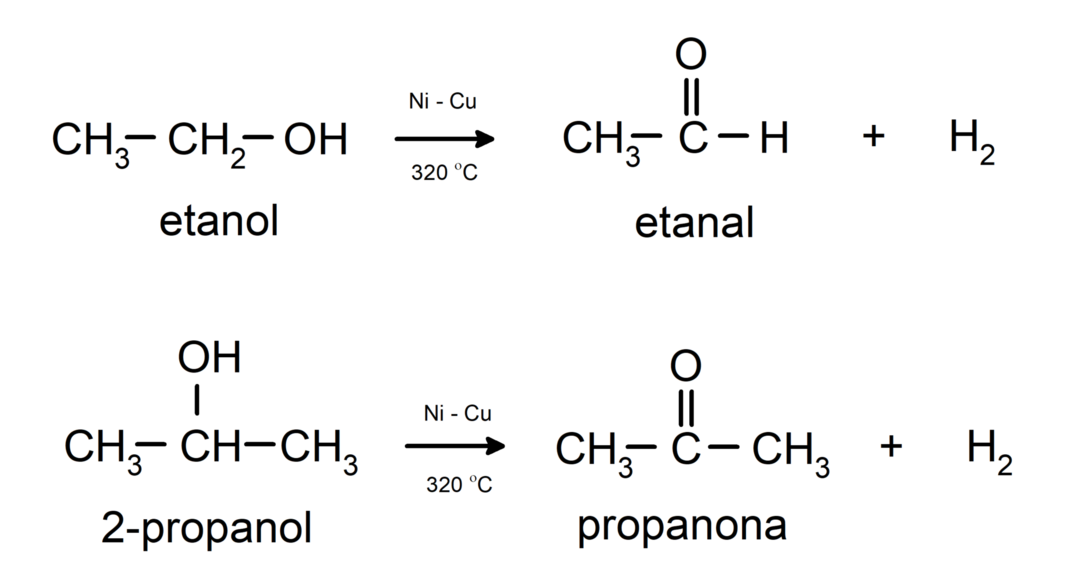
- تخضع الكحوليات لتفاعلات الجفاف. تجفف الكحولات لتشكل الألكينات المقابلة. يحدث هذا التفاعل في وجود درجات الحرارة الحمضية والمتوسطة.
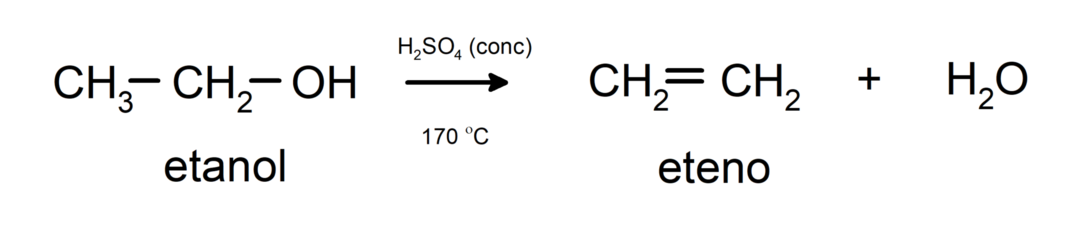
تسميات الكحول
وفقًا للتسمية التي وضعها الاتحاد الدولي للكيمياء البحتة والتطبيقية (IUPAC)، تتم تسمية الكحوليات وفقًا للقواعد التالية:
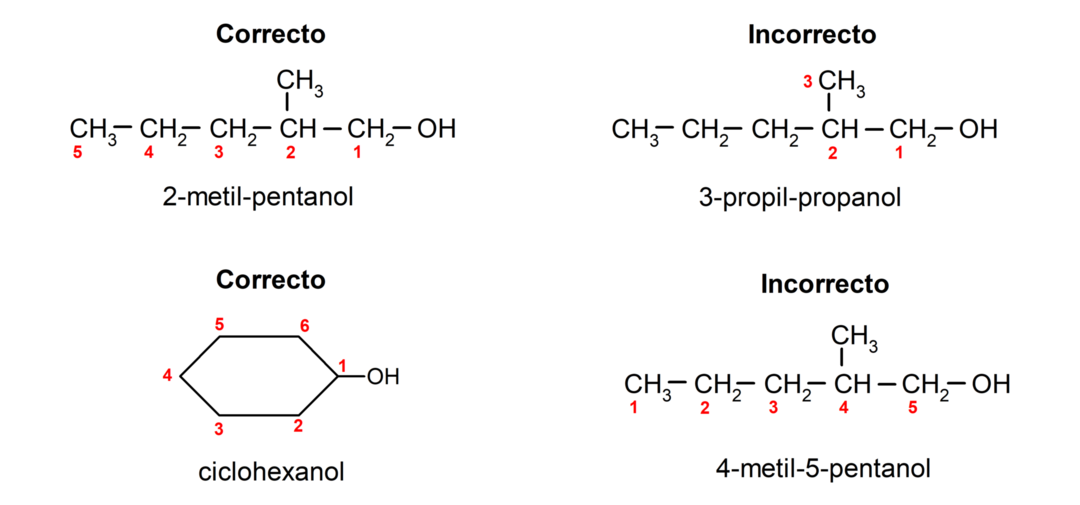
- يتم اختيار موضع مجموعة الهيدروكسيل مع الأخذ في الاعتبار أنها تشغل أقل عدد ممكن في سلسلة الكربون. إذا كانت بنية الكحول حلقية، يتم أخذ الموضع 1 على الكربون الذي يحتوي على مجموعة الهيدروكسيل في الاعتبار ويتم استخدام البادئة cyclo- لتسميته.
- يُكتب اسم الكحول باستخدام البادئات التي تشير إلى عدد الذرات في سلسلة الكربون، وبالإضافة إلى ذلك يتم وضع اللاحقة -ol.
- إذا كان هيكل الكحول له فروع، يتم اختيار أطول سلسلة تحتوي أيضًا على مجموعة الهيدروكسيل لتكون سلسلة الكربون الرئيسية.
حسب التسميات التقليدية تتم تسمية الكحوليات بكتابة كلمة "كحول" ثم كتابة اسم الكحول. ألكان يتوافق مع سلسلة الكربون، ولكن بدلاً من استخدام النهاية -ane للألكان، النهاية -yllic.
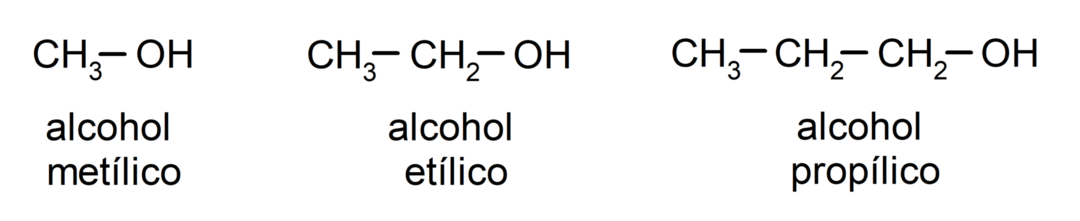
أمثلة على الكحوليات
- الميثانول
- الإيثانول
- 1-بروبانول
- 2-بروبانول
- 1- بيوتانول
- 3-إيثيلهيكسان-2-أول
- الجلسرين
- الفينول
- 2-ميثيل-2-بيوتانول
- 1,2-إيثانيديول
- 1,5-هيبتادين-3-أول
- 3-ميثيل-2-بيوتانول
- بنزيل ميثانول
- 3-بنتانول
- 2-ميثيلفينول
- 1،2-ثنائي هيدروكسي فينول
- سيكلوهيكسنول
- 1-فينيل إيثانول


استخدامات الكحوليات
الاستخدامات الأكثر شيوعًا للكحول هي:
- يتم استخدامها كمطهرات ومطهرات لأنها توقف نمو بعضها الكائنات الدقيقة أو تدميرهم. الأكثر استخدامًا لهذا الغرض هو الإيثانول وكحول الأيزوبروبيل.
- يتم استخدامها في تركيب مختلفة مركبات كيميائية. على سبيل المثال، يستخدم الميثانول للحصول على الميثانال (الفورمالدهيد).
- يتم استخدامها لإنتاج التجمد. ويعتبر الميثانول من أكثر المواد استخداماً لهذا الغرض.
- يتم استخدامها كمذيبات في صناعة الأدوية. يعد الإيثانول من أكثر المواد استخدامًا بهذا المعنى.
- يتم استخدامها كمذيبات للورنيش والأصباغ والأحبار. ويستخدم الميثانول على نطاق واسع لهذا الغرض.
- يتم استخدامها كوقود وهناك ميل مهم لاستبدال استخدامها جزئيًا الوقود الحفري عن طريق استخدام وقود الإيثانول الحيوي.
- يتم استخدامها لصنع الراتنجات. يستخدم الفينول بهذا المعنى.
مخاطر استهلاك الكحول
على الرغم من أن استهلاك الكحول أصبح مقبولًا اجتماعيًا اليوم، إلا أن تعاطي هذه المادة يولد الاعتماد والإدمان.
الإيثانول هو الكحول الموجود في المشروبات الكحولية، والذي يؤثر عند تناوله بكثرة القدرات المعرفية، ويمكن أن تسبب أمراض القلب والأوعية الدموية، وتليف الكبد، و سرطان.
علاوة على ذلك، فإنه عند الوصول إلى درجة التسمم بالكحول، أي حالة السكر، إذا كانت جرعة المخدر الكحول مرتفع جدًا، وقد تحدث غيبوبة كحولية، مما قد يؤدي إلى شلل الجهاز التنفسي وحتى الموت. موت.
مراجع
- ت. ل. جيسمان. (1974) "مبادئ الكيمياء العضوية" الطبعة الثانية. التحرير Reverté، S.A. ردمك: 8429171800
- أهومادا كورتيز، ج. ج.، جاميز المدينة المنورة، م. إي، وفالديز مونتيرو، سي. (2017). استهلاك الكحول كمشكلة صحية عامة. را شيمهاي, 13(2), 13-24.
- موريسون، R. تي، وبويد، آر. ن. (1998). الكيمياء العضوية. تعليم بيرسون.
- وينينجر، س. جيه، وسترميتز، ف. ر. (1988). الكيمياء العضوية. لقد عكست.
اتبع مع:
- الكحول الإيثيلي
- الوقود
- الكيمياء العضوية
