خصائص اللانثانيد
كيمياء / / July 04, 2021
اللانثانيدات هي العناصر الكيميائية التي تتراوح من اللانثانم إلى اللوتيتيوم. أنها تشترك في خصائص مشتركة ، والتي يتم تصنيفها في فئة خاصة في أسفل الجدول الدوري.
الخصائص الرئيسية للانثانيدات:
- تقع في الفترة 6 من الجدول الدوري.
- وهي تغطي 15 عنصرًا ، من 57 إلى 71.
- يتشاركون في هيكل اللانثانم ، الذي يضاف إليه مستوى الطاقة f ، والذي يكون أقل تفاعلًا كيميائيًا.
- لقد أطلقوا عليها اسم الأتربة النادرة لأنها في الحالة الطبيعية يتم دمجها دائمًا لتشكيل أكاسيد.
- بعضها وفير نسبيًا.
- على الرغم من أن لها تكافؤات متغيرة ، إلا أن معظمها بها تكافؤ +3.
- كلما زاد عددها الذري ، يتناقص نصف قطرها.
- كلهم لديهم مظهر معدني لامع.
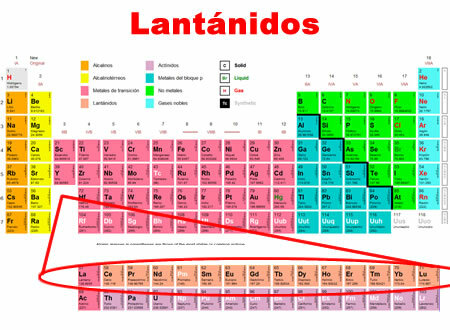
الخصائص الفردية للالانثانيدات:
اللانثانم (لا).
- العدد الذري 57
- الوزن الذري: 139
- الحالة الصلبة
- المظهر: معدني ، فضي أبيض
- فالنسيا: +3
- نقطة الانصهار: 920 درجة مئوية
- نقطة الغليان: 3457 درجة مئوية
تم اكتشافه عام 1839. في الصناعة ، يتم استخدامه في السبائك مع اللانثانيدات الأخرى لصنع أحجار أخف ؛ في البصريات يتم استخدامه للنظارات البصرية. كما أنها تستخدم لإسفنجات الهيدروجين التي تستخدم لاحتواء الغازات. في الطب ، يتم استخدامه على شكل كربونات اللانثانم ، لعلاج الفشل الكلوي ، حيث أن له صلة بالاختلاط مع الفوستات ، مما يقلل من فرط التعرق
السيريوم (م)
- العدد الذري 58
- الوزن الذري: 140
- الحالة: صلبة ناعمة
- المظهر: معدني ، فضي رمادي ، يشبه الحديد
- فالنسيا: +3، +4
- نقطة الانصهار: 798 درجة مئوية
- نقطة الغليان: 3426 درجة مئوية
تم اكتشافه في عام 1803. إنه اللانثانيد الأكثر وفرة. يتم استخدامه لصنع المواد الحفازة ، خاصة للسيارات (المحولات الحفازة) وتكسير الزيت. في شكل أكسيد يستخدم لتلميع النظارات والعدسات. على الرغم من أنه ليس له وظائف بيولوجية معروفة ، فإنه يستخدم في الطب في مراهم للحروق.
البراسيوديميوم (العلاقات العامة)
- العدد الذري 59
- الوزن الذري: 144
- الحالة: صلبة ناعمة
- المظهر: معدني ، فضي أبيض
- فالنسيا: +3
- نقطة الانصهار: 931 درجة مئوية
- نقطة الغليان: 3520 درجة مئوية
تم اكتشافه عام 1841 وعزل عام 1885. في الصناعة ، يتم استخدامه في السبائك التي تحتوي على المغنيسيوم لصنع محركات الطائرات ؛ يستخدم لإعطاء الزجاج والمينا لون أصفر. سبائك النيكل لها خصائص مغناطيسية. يتفاعل مع الهالوجينات لإنتاج الفلوريدات والكلوريدات والبروميدات واليود.
نيوديميوم (Nd)
- العدد الذري 60
- الوزن الذري: 139
- الحالة الصلبة
- المظهر: معدني ، فضي أبيض
- فالنسيا: +3
- نقطة الانصهار: 1024 درجة مئوية
- نقطة الغليان: 3100 درجة مئوية
تم اكتشافه في عام 1885 ، عندما تم عزل البراسيوديميوم ؛ تم عزل النيوديميوم حتى عام 1925. إنها واحدة من أكثر اللانثانيدات تفاعلية. في الصناعة يتم استخدامه لتلوين الزجاج والمينا. نظرًا لقدرته على امتصاص الضوء ، يتم استخدامه في علم الفلك لإنشاء بلورات يتم من خلالها معايرة مطياف الأشعة تحت الحمراء والمرشحات. أحد استخداماته الرئيسية هو صنع مغناطيسات ذات كثافة مغناطيسية عالية. تُستخدم هذه المغناطيسات للأدوات الدقيقة ، مثل تلك المستخدمة في محركات الأقراص الثابتة للكمبيوتر ، وكذلك بعض مكبرات الصوت ذات التنسيق الرفيع.
بروميثيوم (PM)
- العدد الذري 61
- الوزن الذري: 145
- الحالة الصلبة
- مظهر: ؟
- فالنسيا: +3
- نقطة الانصهار: 1100 درجة مئوية
- نقطة الغليان: 3000 درجة مئوية
تم توقع وجودها في عام 1902 ، ولكن لم يكن بالإمكان إثبات وجودها حتى عام 1944. هذا اللانثانيد غير موجود في الطبيعة كونه مصدر الحصول عليه ودراسة انشطار اليورانيوم. عند انشطار اليورانيوم في مفاعل نووي ، فإن إحدى الذرات التي يتم إنتاجها من هذا الفصل الذري هي البروميثيوم. لها خصائص مشعة ، مما يعطيها فسفورة ، وتستخدم في أجهزة المعايرة والبطاريات النووية المستخدمة في المركبات الفضائية.
السماريوم (صغير)
- العدد الذري 62
- الوزن الذري: 150
- الحالة الصلبة
- المظهر: معدني ، فضي أبيض
- فالنسيا: +3
- نقطة الانصهار: 1072 درجة مئوية
- نقطة الغليان: 1803 درجة مئوية
تم اكتشافه عام 1853 وعزل عام 1879. له العديد من النظائر ، واثنان منها على الأقل مشعة. في الصناعة ، يتم استخدامه في البصريات لصنع بلورات تمتص ضوء الأشعة تحت الحمراء. كما أنه يستخدم كمحفز للحصول على الكحول وكعنصر في بعض مصابيح الفلورسنت وأجهزة التلفزيون. أما بالنسبة للصحة في حالة الاستنشاق (مثل الأكسيد المستخدم في تلميع البلورات) ، فيمكن أن يسبب انسدادًا رئويًا أو يؤثر على الكبد. تستخدم النظائر المشعة في العلاج الإشعاعي للمرضى الميؤوس من شفائهم.
اليوروبيوم (الاتحاد الأوروبي)
- العدد الذري 63
- الوزن الذري: 152
- الحالة الصلبة
- المظهر: معدني ، فضي أبيض
- فالنسيا: +2 ، +3
- نقطة الانصهار: 826 درجة مئوية
- نقطة الغليان: 1527 درجة مئوية
تم اكتشافه في عام 1890. إنه الأكثر تفاعلًا من اللانثانيدات. لقد تم استخدامه في مصابيح الفلورسنت وأجهزة التلفزيون ، ولكن للتسبب في انسداد رئوي إذا كان كذلك استنشاق الكبد أو إتلافه إذا تراكم في جسم الإنسان ، فليس له أي استخدامات صناعية تقريبًا. في البحث الذري يتم استخدامه لأنه يمتص النيوترونات.
الجادولينيوم (Gd)
- العدد الذري 64
- الوزن الذري: 157
- الحالة الصلبة
- المظهر: معدني ، فضي أبيض
- فالنسيا: +3
- نقطة الانصهار: 1312 درجة مئوية
- نقطة الغليان: 3250 درجة مئوية
استخدامات الجادولينيوم قليلة ، أهمها التبريد الصناعي المغناطيسي ، لأنه يزيد من خصائصه المغناطيسية في درجات الحرارة المنخفضة ؛ ولكن نظرًا لأن هذا النوع من المبردات يتطلب استخدام الزرنيخ ، فلا يتم استخدامها في التبريد المنزلي. في الطب يتم استخدامه كوسيط تباين للرنين المغناطيسي النووي.
تيربيوم (السل)
- العدد الذري 65
- الوزن الذري: 159
- الحالة الصلبة
- المظهر: معدني ، فضي أبيض
- فالنسيا: +4
- نقطة الانصهار: 1356 درجة مئوية
- نقطة الغليان: 3230 درجة مئوية
تم اكتشافه عام 1843 وعزل عام 1905. إنه مهم جدًا في صناعة الإلكترونيات ، حيث إنه أحد العناصر المستخدمة في صناعة أشباه الموصلات. الاستخدامات الأخرى هي صنع أنابيب الفلورسنت وأنابيب الصور. كما أنها تستخدم كعامل مساعد في خلايا الوقود. على الرغم من أنه ليس له وظائف بيولوجية ، إلا أن استنشاقه أو دخوله إلى جسم الإنسان له آثار سامة ، ويؤثر بشكل أساسي على الكبد.
الديسبروسيوم (دى)
- العدد الذري 66
- الوزن الذري: 162.5
- الحالة الصلبة
- المظهر: معدني ، فضي أبيض
- فالنسيا: +2 ، +3
- نقطة الانصهار: 1407 درجة مئوية
- نقطة الغليان: 2567 درجة مئوية
تم اكتشافه عام 1843 وعزل عام 1905. إنه مهم جدًا في صناعة الإلكترونيات ، حيث إنه أحد العناصر المستخدمة في صناعة أشباه الموصلات. الاستخدامات الأخرى هي صنع أنابيب الفلورسنت وأنابيب الصور. كما أنها تستخدم كعامل مساعد في خلايا الوقود. على الرغم من أنه ليس له وظائف بيولوجية ، إلا أن استنشاقه أو دخوله إلى جسم الإنسان له آثار سامة ، ويؤثر بشكل أساسي على الكبد.
هولميوم (Ho)
- العدد الذري 67
- الوزن الذري: 166
- الحالة الصلبة
- المظهر: معدني ، فضي أبيض
- فالنسيا: +3
- نقطة الانصهار: 1474 درجة مئوية
- نقطة الغليان: 2700 درجة مئوية
تم اكتشافها عام 1878 واسمها مشتق من مدينة اكتشافها ستوكهولم باللاتينية هولميا. ليس له أي استخدامات عملية تقريبًا ؛ ومع ذلك ، يتم استخدامه في بعض الصناعات كمحفز للتفاعلات الكيميائية ، وكذلك لبعض المكونات الإلكترونية. كما أنها تستخدم لتغيير وتيرة وشدة شعاع الليزر.
الإربيوم (إيه)
- العدد الذري 68
- الوزن الذري: 167
- الحالة الصلبة
- المظهر: معدني ، فضي أبيض
- فالنسيا: +3
- نقطة الانصهار: 1795 درجة مئوية
- نقطة الغليان: 2863 درجة مئوية
تم اكتشافه في عام 1843. يتم استخدامه في الصناعة النووية كمخزن نيوتروني. في شكل أكسيد ، يكون ملوّنًا للبلورات ، مما يمنحها لونًا ورديًا ؛ تستخدم هذه البلورات في البصريات والمجوهرات. كما أنها تستخدم في صناعة الألياف البصرية.
الثوليوم (تم)
- العدد الذري 69
- الوزن الذري: 167
- الحالة الصلبة
- المظهر: معدني ، فضي أبيض
- فالنسيا: +3
- نقطة الانصهار: 1545 درجة مئوية
- نقطة الغليان: 1947 درجة مئوية
تم اكتشافه في عام 1879. على الرغم من قلة توافره ، نظرًا لخصائصه المشعة ، فإن استخدامه الرئيسي هو كمصدر للأشعة السينية في المعدات المحمولة ولليزر الحالة الصلبة.
الإيتربيوم (Yb)
- العدد الذري 70
- الوزن الذري: 173
- الحالة الصلبة
- المظهر: معدني ، فضي أبيض
- فالنسيا: +3
- نقطة الانصهار: 824 درجة مئوية
- نقطة الغليان: 1194 درجة مئوية
تم اكتشافه عام 1878 وعزل عام 1907. تستخدم النظائر المشعة لمعدات الأشعة السينية المحمولة التي تعمل بدون كهرباء. كما أنها تستخدم لتحسين سبائك الصلب وزيادة مقاومتها ، وهي خاصية تستخدم في طب الأسنان ، نتيجة لتحسين الخواص الميكانيكية للصلب. يجب التعامل معها بحذر لأنها قد تسبب تهيجًا وحروقًا. بالإضافة إلى ذلك ، عند التفاعل مع الهواء ، يمكن أن يتسبب ذلك في حدوث انفجار أو حريق.
اللوتيتيوم (لو)
- العدد الذري 71
- الوزن الذري: 175
- الحالة الصلبة
- المظهر: معدني ، فضي أبيض
- فالنسيا: +3
- نقطة الانصهار: 1652 درجة مئوية
- نقطة الغليان: 3402 درجة مئوية
تم اكتشافه في عام 1907. إنه العنصر الكيميائي الأقل وفرة في القشرة الأرضية. على الرغم من قلة توافره ، فإنه يستخدم لتكرير النفط وكمحفز لتفاعلات الكيمياء العضوية. تم أيضًا اختبار بعض النظائر المشعة لعلاجات العلاج الإشعاعي.


