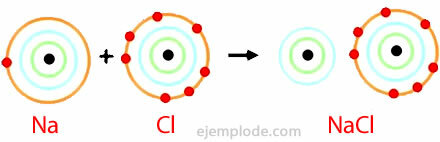
مثال على الرابطة الأيونية
كيمياء / / July 04, 2021
يتم الحصول على الرابطة الأيونية من خلال وجود الكاتيون والأنيون ، وهما نوعان كيميائيان لهما شحنات كهربائية ذات علامات معاكسة. يتم تعريفه على أنه القوة الكهروستاتيكية التي تربط الأيونات في مركب أيوني.
تميل ذرات العناصر ذات طاقات التأين المنخفضة إلى تكوين الكاتيونات. في المقابل ، يميل أولئك الذين لديهم تقارب عالي للإلكترون إلى تكوين الأنيونات
من المرجح أن تشكل الفلزات الأرضية القلوية والقلوية الكاتيونات في المركبات الأيونية ، ومن المرجح أن تشكل الهالوجينات والأكسجين الأنيونات. نتيجة لذلك ، ينتج تكوين مجموعة كبيرة ومتنوعة من المركبات الأيونية من مزيج من مجموعة فلز من المجموعة IA أو IIA مع هالوجين أو أكسجين.
على سبيل المثال ، ينتج عن التفاعل بين الليثيوم والفلور فلوريد الليثيوم ، وهو مسحوق أبيض سام يستخدم لخفض درجة انصهار اللحام وفي صناعة السيراميك. تكوين الإلكترون لليثيوم هو 1 ثانية2، 2 ثانية1، و الفلور هو 1 ثانية2، 2 ثانية2، 2 ص5. عندما تتلامس هذه الذرات ، فإن إلكترون التكافؤ 2s1 يتم نقل الليثيوم إلى ذرة الفلور.
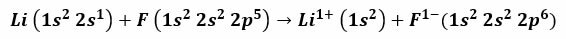
من الصحيح أن نفترض أن الإجراء يبدأ بفصل إلكترون الليثيوم ، مؤينًا هذا للوصول إلى التكافؤ الموجب 1+. يستمر في استقبال هذا الإلكترون بواسطة الفلور ، مما يعطيه شحنة سالبة. في النهاية ، يحدث تكوين الرابطة الأيونية عن طريق الجذب الكهروستاتيكي. سيكون مركب فلوريد الليثيوم محايدًا كهربائيًا.
تؤدي العديد من التفاعلات الشائعة إلى تكوين روابط أيونية. على سبيل المثال ، ينتج عن احتراق الكالسيوم في الأكسجين أكسيد الكالسيوم:
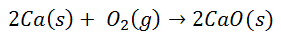
ينقسم جزيء الأكسجين ثنائي الذرة إلى ذرتين فرديتين. ثم يتم نقل إلكترونين من ذرة الكالسيوم إلى كل ذرة أكسجين. سيكون لكل منهما شحنة خاصة بهما: الكالسيوم 2+ لكل ذرة ، والأكسجين 2 لكل ذرة. عند الارتباط النهائي ، يكون جزيء أكسيد الكالسيوم متعادل كهربائيًا.
طاقة شعرية للمركبات الأيونية
مع طاقة التأين وقيم تقارب الإلكترون للعناصر ، من الممكن التنبؤ بماذا تشكل العناصر مركبات أيونية ، ولكن من الضروري أيضًا تقييم ثبات هذا النوع من مجمعات سكنية.
يتم تحديد طاقة التأين وتقارب الإلكترون للعمليات التي تحدث في الطور الغازي ، على الرغم من أن جميع المركبات الأيونية صلبة عند ضغط جوي واحد و 25 درجة مئوية. الحالة الصلبة هي حالة مختلفة تمامًا لأن كل كاتيون محاط بعدد معين من الأنيونات والعكس صحيح. وبالتالي ، فإن الاستقرار الكلي للمركب الأيوني الصلب يعتمد على تفاعلات جميع الأيونات وليس فقط على تفاعل الكاتيون مع الأنيون.
المقياس الكمي لاستقرار أي مادة صلبة أيونية هو الطاقة الشبيكة، والتي يتم تعريفها على أنها الطاقة اللازمة لفصل جزيء مركب أيوني صلب تمامًا إلى أيوناته في الحالة الغازية.
دورة Born-Haber لتحديد طاقة الشبكة
لا يمكن قياس طاقة الشبكة مباشرة. ومع ذلك ، إذا كانت بنية المركب الأيوني وتكوينه معروفين ، فمن الممكن حساب طاقته الشبكية من خلال تطبيق قانون كولوم ، والذي تنص على أن الطاقة الكامنة بين أيونيين تتناسب طرديًا مع ناتج شحناتها وتتناسب عكسيًا مع المسافة بينهما. للتوقف.
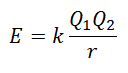
نظرًا لأن شحنة الكاتيون موجبة وشحنة الأنيون سالبة ، فسيعطي المنتج نتيجة سلبية في الطاقة. هذا يمثل رد فعل طارد للحرارة. وبالتالي ، لعكس العملية ، يجب توفير الطاقة.
من الممكن أيضًا تحديد طاقة الشبكة بشكل غير مباشر إذا افترض أن مركب أيوني يتكون على عدة مراحل. يُعرف هذا الإجراء باسم دورة بورن هابر، والتي تربط الطاقات الشبكية للمركبات الأيونية مع طاقات التأين ، والتقارب الإلكتروني ، والخصائص الذرية والجزيئية الأخرى. تعتمد هذه الطريقة على قانون هيس للمجمع الجبري للتفاعلات الكيميائية ، وقد طورها ماكس بورن وفريتز هابر. تحدد دورة Born-Haber المراحل المختلفة التي تسبق تكوين المادة الصلبة الأيونية.

كلوريد الصوديوم
كلوريد الصوديوم مركب أيوني بنقطة انصهار 801 درجة مئوية ، والذي يقوم بتوصيل الكهرباء في الحالة المنصهرة وفي محلول مائي. الملح الصخري هو أحد مصادر كلوريد الصوديوم ويوجد في الترسبات الجوفية التي غالبًا ما تكون بسمك عدة مئات من الأمتار. يتم الحصول على كلوريد الصوديوم أيضًا من مياه البحر أو من محلول ملحي (محلول كلوريد الصوديوم المركز) عن طريق التبخر الشمسي. كما يوجد في الطبيعة في المعدن المسمى Halite.

يستخدم كلوريد الصوديوم أكثر من أي مادة أخرى في تصنيع المركبات الكيميائية غير العضوية. يبلغ الاستهلاك العالمي لهذه المادة حوالي 150 مليون طن سنويًا. يستخدم كلوريد الصوديوم بشكل أساسي في إنتاج المركبات الكيميائية غير العضوية الأخرى ، مثل غاز الكلور ، وهيدروكسيد الصوديوم ، والصوديوم المعدني ، وغاز الهيدروجين ، وكربونات الصوديوم. كما أنها تستخدم لإذابة الجليد والثلج على الطرق السريعة والطرق.