مثال الطاقة الكيميائية
كيمياء / / July 04, 2021
ال الطاقة الكيميائية هي تلك التي تأتي من التفاعلات الكيميائية. يؤدي التفاعل بين الأنواع الكيميائية إلى تكسر و / أو توليد روابط ، مما يعني إطلاق أو امتصاص الطاقة ، على التوالي. تسمى الطاقة الكيميائية الطاقة المنبعثة ، والتي يمكن استخدامها على سبيل المثال كطاقة حرارية وطاقة كهربائية.
الطاقة في التفاعلات الكيميائية
يمكن الحصول على الطاقة الكيميائية بأقصى تعبير لها من مصدرين رئيسيين: الاحتراق والمحاليل الالكتروليتية. من ناحية أخرى ، على مستوى جسم الإنسان ، من الممكن الحصول على الطاقة من خلال التفكك الكيميائي للغذاء.
طاقة الاحتراق
على سبيل المثال ، عندما يكون وقود الميثان CH4، أبسط هيدروكربون ، يبدأ في الاحتراق بوجود مؤكسد الأكسجين ، وسوف يتفكك ، لتشكيل منتجات ثاني أكسيد الكربون.2 والماء ح2أو. بالإضافة إلى ذلك ، فإن كسر روابط ذرات الهيدروجين مع ذرات الكربون سيطلق طاقة على شكل حرارة.
CH4 (ز) + 2 س2 (ز) → CO2 (ز) + 2 ح2 O (l) ∆H = -212.8 كيلو كالوري / مول
معادلة احتراق الميثان. يتم تمثيل حرارة هذا التفاعل بواسطة ΔH. تشير العلامة السلبية إلى تحرير الطاقة. التفاعل طارد للحرارة.
 احتراق غاز الميثان. يتجلى رد الفعل بلهب.
احتراق غاز الميثان. يتجلى رد الفعل بلهب.
أمثلة على درجات حرارة احتراق المركبات العضوية عند 25 درجة مئوية.
مجمع |
معادلة |
ΔH (كيلو كالوري / مول) |
الميثان (غ) |
CH4 |
-212.80 |
الإيثان (غ) |
ج2ح6 |
-372.82 |
البروبان (غ) |
ج3ح8 |
-530.60 |
ن- البيوتان (غ) |
ج4ح10 |
-687.98 |
ن-بنتان (غ) |
ج5ح12 |
-845.16 |
الإيثيلين (غ) |
ج2ح4 |
-337.23 |
الأسيتيلين (غ) |
ج2ح2 |
-310.62 |
بنزين (غ) |
ج6ح6 |
-787.20 |
بنزين (لتر) |
ج6ح6 |
-780.98 |
التولوين (لتر) |
ج7ح8 |
-934.50 |
النفثالين |
ج10ح8 |
-1,228.18 |
السكروز (ق) |
ج12ح22أو11 |
-1,348.90 |
الميثانول (لتر) |
CH3أوه |
-173.67 |
الإيثانول (لتر) |
ج2ح5أوه |
-326.70 |
حمض الخليك (ل) |
CH3COOH |
-208.34 |
حمض (أحماض) البنزويك |
ج6ح5COOH |
-771.20 |
لكي يوفر الوقود كل حرارة الاحتراق التي يمكنه القيام بها ، يجب أن يكون في حالة غازية. كما يتضح من الجدول ، يساهم البنزين السائل في حرارة احتراق تبلغ 6.22 كيلو كالوري / مول أقل من تلك الناتجة عن البنزين الغازي. هذا يعني أنه يجب استثمار 6.22 كيلو كالوري / مول لإجراء التغيير من السائل إلى الغاز.
انقر للحصول على مزيد من المعلومات حول الوقود.
طاقة المحاليل الالكتروليتية
الموصل الإلكتروليتي هو وسيط يشارك فيه نوع أو أكثر من الأنواع الأيونية ، وهو مشتتة بشحنتها الكهربائية ، مما يسمح للتيار الكهربائي بالمرور عبرها دستور. المحاليل الإلكتروليتية هي موصلات إلكتروليتية.
تشمل الموصلات الإلكتروليتية ، بالإضافة إلى محاليل الإلكتروليت ، الأملاح المنصهرة ، وكذلك بعض الأملاح الصلبة ، مثل كلوريد الصوديوم NaCl ونترات الفضة AgNO3.
يحدث نقل الإلكترون عن طريق الهجرة الأيونية ، الموجبة والسالبة ، نحو الأقطاب الكهربائية. لا تقتصر هذه الهجرة على نقل الكهرباء فحسب ، بل تشمل أيضًا نقل المادة من جزء من الموصل إلى جزء آخر.
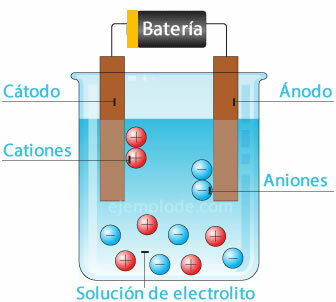 الخلية الكهروكيميائية
الخلية الكهروكيميائية
توصيل مصدر محتمل بالقطب الكهربائي المعدني (الكاثود والأنود) وغمرها في أ محلول مائي ، سوف تنتقل الإلكترونات عبر الأنود ، للهروب من المحلول إلى القطب الموجب لل نافورة. هذا هو الحال ، على سبيل المثال ، مع أيون الكلوريد ، الذي يتم إطلاقه من إلكترونه ، وبشحنة متعادلة بالفعل ، ينضم إلى ذرة كلور أخرى ، لتشكيل الجزيء ثنائي الذرة. سوف يتسرب غاز الكلور من المحلول.
2 سل- = 2Cl + 2e-
سيتم وضع الإلكترونات التي تغادر القطب السالب للمصدر في الكاثود المغمور. ستأخذ الأنواع الموجودة في المحلول المائي (الأيونات) الإلكترونات من الكاثود. على سبيل المثال ، أخذت أيونات الهيدروجين التي تتكون منها المياه ، بعد أن كانت في شحنة موجبة إلكترون يتم تحييده ، وربطه بذرة هيدروجين أخرى لتكوين الجزيء ثنائي الذرة. سوف يهرب كغاز هيدروجين من المحلول.
2 ح+ + 2 هـ- = 2 ح
2 ح = ح2 (ز)
يمكن أن يدعم هذا التبادل للإلكترونات تشغيل بطاريات السيارات ، والتي تتكون من أقطاب الرصاص الرصاص المغمورة في محلول حمض الكبريتيك H2جنوب غرب4.
يتم الحصول على هذه الطاقة نفسها في جميع أنواع البطاريات التي يتم التعامل معها على المستوى المحلي: 9V ، AA ، AAA ، D ، على سبيل المثال لا الحصر.
الطاقة الغذائية
يستوعب البشر الطاقة التي يطلقها تفكيك الطعام الذي نأكله في أجسامنا. هذه الطاقة هي ما يستخدمه جسمنا للوظائف غير الواعية (الهضم ، وضربات القلب ، والوظائف الخلوية) وتلك التي نقوم بها.
طالما لم يكن لديك نشاط بدني مكثف وكان الأيض بطيئًا ، فمن المستحسن تناول السعرات الحرارية بانتظام ، لأن الأطعمة عالية في يصعب تكسير الدهون المعقدة والكربوهيدرات ، والتي لها هياكل كبيرة جدًا ، مما يؤدي إلى انعكاس طاقة. في هذه الحالة سيكون التأثير معاكسًا للحظات.
يُنصح بتناول الفاكهة عند وجوب العمل ليلاً ، وذلك لاحتوائها على الفركتوز ، كربوهيدرات بسيطة يسهل تكسيرها وستتوفر لنا الطاقة بعد تناولها استهلاك.
الطاقة الكيميائية وتحولاتها
محطات كهروحرارية
يتم استخدام الوقود الثقيل في محطات الطاقة الكهروحرارية للحصول على قيمة حرارية عالية وطويلة الأمد. بشكل عام هو زيت الوقود (زيت الوقود). الاحتراق ، وهو المرحلة الكيميائية للعملية ، سيكون بمثابة عامل تسخين للغلاية ، والذي سيولد بخارًا مشبعًا. سيخرج هذا البخار تحت الضغط عبر شبكة توزيع البخار وسيبدأ في تحريك توربينات المولد. ستنتج هذه الأجهزة الطاقة الكهربائية لتزويد السكان المطابقين.
الطاقة الكيميائية ← الطاقة الميكانيكية ← الطاقة الكهربائية
تشغيل السيارات
تعتمد السيارات على مصدر للطاقة وهو البطارية. في البطارية ، من المعروف بالفعل حدوث التوصيل الإلكتروليتي ، والذي يعمل على تشغيل نظام الإشعال وملحقات لوحة العدادات ومنافذ الطاقة الإضافية. بفضل هذه الكهرباء المتوفرة ، ستكون السيارة قادرة على التحرك لتأخذ السائق إلى الموقع المطلوب.
الطاقة الكيميائية ← الطاقة الكهربائية ← الطاقة الميكانيكية

