20 Примери за киселини
Miscellanea / / July 04, 2021
The киселини съставят важна група от химични съединения, много широк. Киселините обикновено се определят като съединения, които могат да дарят едно или повече катиони водород (Н+) към друго съединение, известно като база. Въпреки че в действителност киселините се определят според няколко теории:
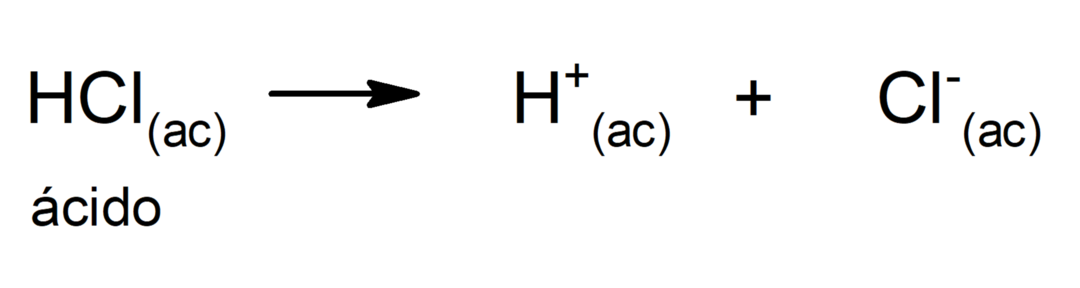 Ограничението на тази теория е, че киселините се определят само във воден разтвор.
Ограничението на тази теория е, че киселините се определят само във воден разтвор. 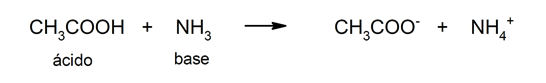

Свойството на освобождаване водородни катиони е това, което кара киселините да произвеждат разтвори на рН по-малко от 7. Киселини, които могат да освободят повече от един протон (използвайки това име за H+) се наричат полипротични или полифункционални.
Киселинни свойства
По отношение на техните Имоти, киселините могат да бъдат представени като течности или като газове, по-рядко като твърдо. Вкусът на киселина, който можем да разпознаем и който характеризира тези съединения, откриваме например в цитрусови плодове, които са богати на лимонена киселина, или оцет, който е киселинен разтвор оцетна. Това са органични киселини.
съществуват органични и неорганични киселини; най-силните обикновено са неорганичните. Много органични киселини изпълняват важни биологични роли. Сред неорганичните има една, солната киселина, която играе много важна роля в процеса на храносмилането. The нуклеинова киселина Те също са от основно значение за живота, тъй като са в основата на генетичния материал на клетки и съдържат ключа за синтеза на протеин.
Тенденцията към загуба на протони е това, което определя силата на киселината.
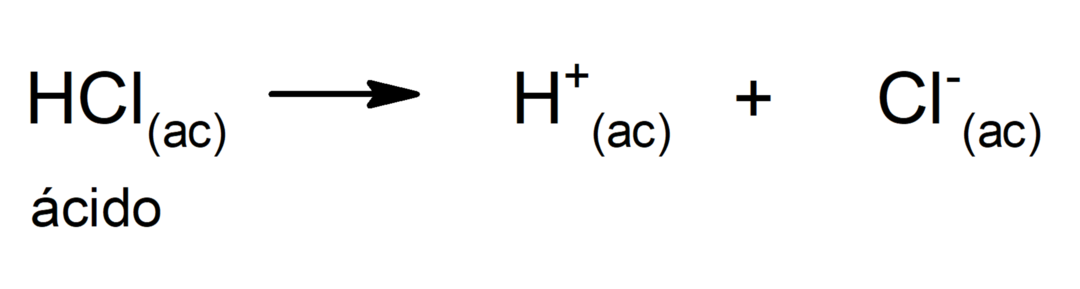
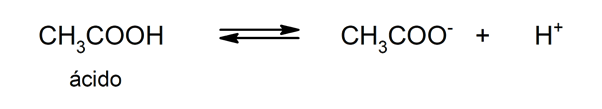
Употреба на киселини
Киселини имат много приложения, както в промишлен, така и в домашен мащаб. Те често се използват като добавки и консерванти в храна, козметика, напитки и др. Някои кисели твърди вещества се използват като катализатори (ускорители на химични реакции) в нефтохимическата или хартиената промишленост.
Има и киселини, които се използват като дезинфектанти (карболова киселина, салицилова киселина). Освен това те могат да се използват като електролити в автомобилните акумулатори, какъвто е случаят със сярна киселина. Последната силна киселина също често се използва при преработката на минералиТакъв е случаят с производството на торове от скални фосфати.
Струва си да се изясни, че някои вещества могат да бъдат разтворени само в кисела среда и че определени реакции се случват само при такива условия. Азотната киселина и амонякът правят амониев нитрат, също важен тор за посевите.
Примери за киселини
Двадесет киселини са изброени по-долу, като пример:
- Перхлорна киселина (HClO4). Това е силна киселинна течност a температура среда, силно окисляваща.
- Азотна киселина (HNO3). Това е силна и интензивно окисляваща се киселина, използвана за направата на някои експлозиви, а също и азотни торове.
- Аскорбинова киселина (C6Н8ИЛИ6). Това е витамин С, толкова необходим за здравето. Той е защитно вещество за своите антиоксидантни ефекти.
- Солна киселина (HCl(променлив ток)). Това е единствената силна киселина, която човешкото тяло синтезира, процес, който се случва конкретно в стомаха, за да извърши разграждането на храна в храносмилателния процес.
- Винена киселина (C4Н6ИЛИ6). Това е бял кристален прах, използва се при приготвянето на ефервесцентни напитки, в хлебната, винарската и фармацевтичната индустрия. Кремът от зъбен камък, който някои рецепти носят, е винена киселина.
- Флуороводородна киселина (HF(променлив ток)). Поради способността си да атакува стъкло, той се използва в кристалната резба и гравирането.
- Сярна киселина (H2ЮЗ4). Това е силна киселина par excellence, има безброй приложения в различни индустрии и синтезни процеси.
- Трифлуороцетна киселина (C2HF3ИЛИ2). Това е добър разтворител за мнозина органични съединения.
- Фосфорна киселина (H3PO4). Той присъства (в ниски концентрации) в различни напитки от кола. Счита се за вредно за здравето, тъй като насърчава декалцификацията.
- Оцетна киселина (СН3COOH). Той е основният компонент на оцета. Киселинността, която създава, го прави широко използван консервант за храна.
- Флуороантимонова киселина (SbHF6). Това е най-силната известна суперкиселина, надвишаваща киселинността на чистата сярна киселина с 1019.
- Хромна киселина (H2CrO4). Това е тъмночервен прах, той участва в процеса на хромиране. Използва се и за глазиране на керамика.
- Индооцетна киселина (С10Н9НЕ2). Той е основният представител на ауксините, важни за растежните хормони на растения.
- Дезоксирибонуклеинова киселина (ДНК). Той е този, който държи ключа за живота, тъй като съставлява гените, които управляват синтеза на безброй протеини.
- Трикарбонови киселини. Те включват група карбоксилни киселини, които имат три карбоксилни групи (-COOH). Лимонена киселина (C6Н8ИЛИ7) Това е един от тях.
- Мравчена киселина (СН2ИЛИ2). Това е най-простата от органичните киселини. Продължителното излагане на тази киселина може да причини дихателна недостатъчност и смърт.
- Глюконова киселина (C6Н12ИЛИ7). Солите на тази киселина се използват широко в процесите на почистване на стъклени съдове.
- Млечна киселина (C3Н6ИЛИ3). Той е важна част от биохимичните процеси.
- Бензоена киселина (C7Н6ИЛИ2). Това е киселина с характерна миризма, която се използва широко за запазване на храни, които изискват a рН киселина.
- Ябълчена киселина (C4Н6ИЛИ5). Той се използва широко във фармацевтичната индустрия за производство на лаксативи.
- Въглеродна киселина (H2CO3). На някои места е част от процеса на формиране на пещерите. Той присъства в газираните напитки.
