20 Примери за алкани
Miscellanea / / July 04, 2021
The алкани те са един вид въглеводороди в която променлив брой въглеродни атоми са свързани заедно с единични връзки, като скелет, и всеки въглероден атом от своя страна е свързан с водородни атоми, които в крайна сметка могат да бъдат заменени от други атоми или функционални групи. Например: хлороформ, метан, октан.
The молекулярна формула на алканите с отворена линейна верига е CnH2n + 2, където C представлява въглерод, H представлява водород и n представлява броят на въглеродните атоми. Алканите са наситени въглеводороди, което означава, че нямат двойни или тройни връзки. За да ги наименувате, използвате наставка "-Ano" след именуване на въглеродната верига с помощта на префикс съответстващ на броя на въглеродните атоми (et- (2), pro- (3), but- (4), pen- (5), hex- (6), hep- (7) и др.).
Може да ви служи:
Класификация на алканите
В алканите те обикновено се разпознават две големи групи: отворена верига (наричана още ациклична) и затворена верига (или циклична).
Когато съединения с отворена верига
Те не представят никакво заместване на водородите, които придружават всеки въглероден атом, те се наричат линейни алкани: това са най-простите алкани. Когато представляват заместване на който и да е от техните водороди с една или повече въглеродни вериги, те се наричат разклонени алкани. Най-често срещаните заместители са етиловите групи (СН3CH2-) и метил (СН3-).От своя страна в молекулата има съединения с един цикъл (моноциклични) и други с няколко (полициклични). The циклични алкани те могат да бъдат хомоциклични (образуват се с изключителната намеса на въглеродни атоми) или хетероциклични (в които участват други атоми, например кислород или сяра).
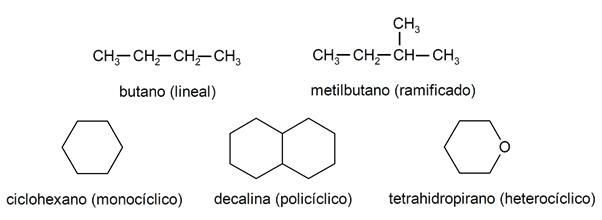
Физични свойства на алканите
Общо взето, физични свойства алкани се обуславят от молекулната маса (от своя страна свързана с дължината на въглеродната верига). Тези с най-малък брой въглероди са газообразен да се температура околната среда, тези, вариращи от 5 до 18 въглеродни атоми са течности, и над това число са твърдо (подобно на восък).
Тъй като са по-малко плътни от водата, те са склонни да плуват по нея. По принцип алканите са неразтворими във вода и разтворими в органични разтворители.
Смисълът на кипене и на синтез на алканите зависи от тяхната молекулна маса, тоест от дължината на въглеродната верига, въпреки че те също многократно зависят от пространственото разположение на атомите. Линейните и цикличните алкани имат по-високи точки на кипене от разклонените.
Химични свойства на алканите
Алканите се характеризират с това, че са химични съединения на много лоша реактивност, поради което те са известни и като "парафини" (на латински, parum affinis означава "нисък афинитет"). Те са съединения, които имат много висока енергия на активиране, когато участват в тях химична реакция. Най-важната реакция, която алканите могат да претърпят, е изгаряне генерирайки в присъствието на кислород, топлина, въглероден диоксид и вода.
Алканите са основата за важно разнообразие от реакции, свързани с индустриални процеси много важно, тъй като са най-традиционните горива. Те се появяват и като крайни продукти от биологични процеси като метаногенна ферментация, извършена от някои микроорганизми.
Примери за алкани
Някои примери за алкани (включително някои добре познати линейни и разклонени) са:
- Хлороформ (фантастично име на трихлорметан; СНС13). Парите на това вещество се използваха преди като анестетици. За тази цел той е прекратен, тъй като е установено, че е повреден органи важно като черния дроб или бъбреците. Днес използването му е предимно като разтворител или охлаждаща течност.
- Метан (СН4). Това е най-простият алкан от всички: той се състои само от един въглероден атом и четири водородни атома. Това е газ, който се получава естествено чрез разлагането на различни органични субстрати и е основният компонент на природния газ. В последно време той е признат за един от газовете, които допринасят най-много за така наречения парников ефект.
- Октан (° С8Н18). Това е алканът с осем въглерода и е от голямо значение, тъй като определя крайното качество на нафтата, която е разбъркайте на различни въглеводороди. Това качество се измерва с октановото или октановото число на горивото, което приема за еталон нискодетониращо (индекс 100) и силно детониращо (индекс 0).
- Хексан (° С6Н14). Той е важен разтворител, неговото вдишване трябва да се избягва, тъй като е много токсичен.
- Бутан (° С4Н10). Заедно с пропан (C3Н8), съставляват така наречените втечнени петролни газове (LPG), които се образуват в газови торбички по време на процеса на извличане на масло. Понастоящем се насърчава замяната на бензин или дизел с пропан-бутан като гориво, тъй като това е така на по-екологичен въглеводород (по време на изгарянето си той отделя само въглероден диоксид и вода).
- Icosano (° С20Н42). Това е алканът с двадесет въглерода (префиксът „ico“ означава двадесет)
- Циклопропан (° С3Н6). Преди това се използваше като упойка
- н-хептан (° С7Н16). Тя е тази, която се приема за еталон за нулевата точка на бензиновата октанова скала, която би била най-малко желана, тъй като изгаря експлозивно. Получава се от смола на определени растения.
- 3-етил-2,3-диметилпентан (° С9Н20)
- 2-метилбутан (° С5Н12)
- 3-хлоро-4-п-пропилхептан (° С10Н21Cl)
- 3,4,6-триметилхептан (° С10Н22)
- 1-бромо-2-фенилетан (° С8Н9Br)
- 3-етил-4-метилхексан (° С9Н18)
- 5-изопропил-3-метилнонан (° С13Н28)
- Кубински (° С8Н8)
- 1-бромопропан (° С3Н7Br)
- 3-метил-5-п-пропилоктан (° С12Н26)
- 5-n-бутил-4,7-диетилдекан (° С18Н28)
- 3,3-диметилдекан (° С12Н26)
