Пример за органични и неорганични молекули
Химия / / November 13, 2021
The Обща химия науката е тази, която изучава всички видове материя, които съществуват, и техния вътрешни промени имащи контакт между различни видове това.
The Органична химия Това е частта от общата химия, предназначена да изучава материята, чиято основна съставка е Въглероден елемент, И какво той е част от живите организми.
The Неорганична химия Именно частта от общата химия е отговорна за изучаването на т.нар "минерална материя", което е част от Аз не живея среда.
The Молекула е обединението на различни атоми на различни елементи химикали за образуване на нови вещества с техните специфични свойства.
В общата химия, Елементи Има ли чисти вещества които се образуват от атоми от един тип. Елементите са класифицирани в Периодичната система на химическите елементи.
Точно като него Атомът е основната единица на Елементите, Молекулата е основната единица на съединенията, които са вещества, които имат характерно химично поведение.
The Съединения може да се формира като последица от природен феномен
, или да бъдат създадени в лаборатории или в Промишлени предприятия, така че молекулите присъстват навсякъде. Молекулите се намират в минералите, в листата на дърветата, в храната, в лекарствата, във водата, която пием, във въздуха, който дишаме, и дори в замърсяването на околната среда.Общата химия се разделя главно на Неорганична химия Y. Химическида се Orgнica, така че молекулите също могат да бъдат класифицирани в неорганични и органични.
Неорганични молекули
В неорганичната химия молекулите се образуват предимно от комбинация от атоми на положителни валенции с други на отрицателни валенции, в йонни връзки. Тези връзки се образуват главно от електромагнитните сили между атомите, генерирани от присъствието на валентните електрони.
Така възникват всички йонни съединения, като соли, оксисоли, киселини, оксикиселини, оксиди и хидроксиди.
Неорганични молекули като електролити
Основното свойство на йонните молекули е, че когато влязат в контакт с вода H2ИЛИ, те са разделени на двете му части: положителна и отрицателна. Тези две части, електрически заредени атоми или групи атоми, се разпръскват във водата. Към неорганичното вещество, способно по този начин да се отдели във вода, нарича се Електролит.
Извиква се разтворът, образуван от вода и положително и отрицателно заредени частици "Електролитен разтвор". Този тип разтвор има способността да провежда електрически токове, поради което се използва в електрохимични клетки, като автомобилни батерии.
Неорганични киселини и алкални молекули
В случай на неорганични молекули като Киселини, Оксиациди и Хидроксиди, в същото време, когато се разделят на положителна и отрицателна част, те допринасят за решението свойство, наречено Водороден потенциал, измерено като отрицателен логаритъм на концентрация на водородни йони.
The Водороден потенциал (pH) определя доколко разтворът е кисел. На скалата на рН, която варира от стойност 1 за максимална киселинност до 14, което е пълна алкалност или основност, киселинният характер варира от стойности 1 до 6, а алкалната е между 8 и 14. 7 представлява неутрално рН; нито киселинни, нито основни. Резултатът от отрицателния логаритъм на концентрацията Н + ще ни каже къде сме на скалата.
Примери за киселини:
Солна киселина: HCl: H+ + Cl-
Бромоводородна киселина: HBr: H+ + Br-
Сероводородна киселина: Н2S: 2H+ + S-2
Цианхидридна киселина: HCN: H+ + CN-
Солна киселина: HI: H+ + Аз-
Примери за оксикиселини:
Сярна киселина: H2ЮЗ4: 2Н+ + ТАКА4-2
Въглеродна киселина: H2CO3: 2Н+ + СО3-2
Азотна киселина: HNO3: H+ + НЕ3-
Фосфорна киселина: H3PO4: 3H+ + PO4-3
Перхлорна киселина: HClO4: H+ + ClO4-
Примери за хидроксиди:
Натриев хидроксид: NaOH: Na+ + ОН-
Калциев хидроксид: Ca (OH)2: Ca+ + 2ОН-
Амониев хидроксид: NH4OH: NH4+ + ОН-
Калиев хидроксид: KOH: K+ + ОН-
Магнезиев хидроксид: Mg (OH)2: Mg+ + 2ОН-
Неорганични молекули в химични реакции
Когато неорганичните молекули участват в химична реакция, има четири основни и прости механизма на реакция: Синтез, разлагане, просто заместване и двойно заместване. Ето пример за всеки:
Синтез
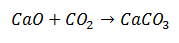
Реакция на синтез е тази, при която две молекули се събират в краен продукт, състоящ се от една молекула. В примера това е случаят на калциев оксид, който се комбинира с въглероден диоксид, за да образува молекула на калциев карбонат.
Разлагане:

Реакцията на разлагане е тази, при която начална молекула се разделя на две нови стабилни молекули. Такъв е случаят с калциевия хидроксид, разделящ се на молекула калциев оксид и друга на вода.
Обикновено заместване:

В проста реакция на заместване, атом на елемент се обменя с един от атомите на молекулата. Такъв е случаят с металния цинк, който се поставя на мястото на водорода в хлороводорода, освобождавайки го и образувайки молекули на цинков хлорид.
Двойна Замяна:
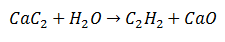
В реакция на двойна замяна, някои атоми на две първоначални молекули се обменят, за да генерират като продукти две различни молекули. Такъв е случаят с калциевия карбид, който претърпява освобождаването на въглерод, който ще се комбинира с водорода от водата, за да образува ацетилен. Калцият ще се свърже с кислорода, за да образува калциев оксид като втори продукт.
Органични молекули
Органичната химия е въглеродната химия, което означава, че всички органични молекули ще имат присъствието на този елемент, в различни структурни механизми.
Органичните молекули се характеризират с постоянно присъствие на ковалентни връзки. Ковалентни облигации с тези, в които два атома се обединяват, за да споделят валентните си електрони и по този начин взаимно допълват своите октети.
Такъв е случаят с Carbon, който се свързва с други атоми на същия елемент. Образуват се вериги с много различна дължина от два до шестдесет въглеродни атома и дори тези вериги те се разклоняват с други вериги със същото разнообразие от дължини, постигайки огромно разнообразие от молекули органични.
Йонни връзки също присъстват, но те се появяват в междинните етапи на дългите реакционни механизми, в които се образува желаната молекула.
Най-простите органични молекули включват въглерод и водород. Последният завършва валентността на въглерода, която го изисква.
В органичната химия молекулите могат да бъдат линейни или алифатни, разклонени, циклични и ароматни.
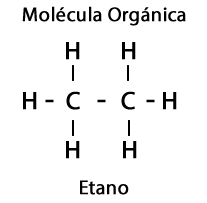
Освен това елементите кислород, азот, сяра и фосфор участват в органичните молекули, което поражда впечатляващо разнообразие от функционални групи за молекулите.
Функционални групи в органични молекули
The Функционални групи са групи от два или повече атома, които, когато се присъединят към въглерод-водородна верига, образуват различни химични видове, с определено поведение. След това са изброени седемте основни типа органични молекули със съответните им функционални групи. Буквата "R" се използва за означаване на въглерод-водородната верига.
Алкил халогениди - Форма: R-X / Функционална група: Халогенен елемент (хлор, бром, йод)

Алкохоли - Форма: R-OH / Функционална група: -OH или хидроксил.
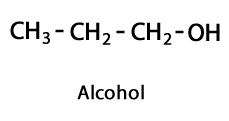
Алдехиди - Форма: R-CHO / Функционална група: -CHO, която винаги отива в края на веригата.
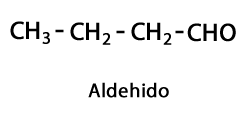
Кетони - Форма: R-CO-R / Функционална група: -CO- или Carboxy, винаги в средата Carbon на веригата.
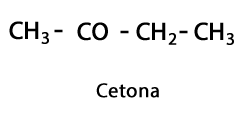
Органични киселини - Форма: R-COOH / Функционална група: -COOH или карбоксил, винаги в края на веригата.
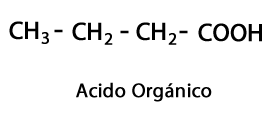
Киселинни естери - Форма: R-COO-R / Функционална група: -COO-, е резултат от присъединяването на киселинна верига към друга верига въглерод-водород.
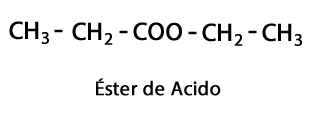
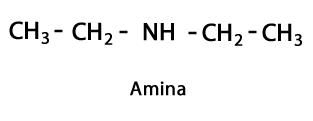
Амини - Форма: R-NH2, R-NH-R, R-N-2R / Функционална група: -NH2, -NH-, -N = или амино, което е азот, допълнен с водород в местата, където няма въглерод-водородна верига. Както беше посочено, той може да отиде в края на веригата или в средата. Азотният атом може да бъде придружен от една, две или три органични вериги, за да образува крайна молекула. Амините могат да се считат за органични производни на амоняк NH3.
Органични молекули в химични реакции
Органичните молекули, колкото по-дълги са техните въглерод-водородни вериги, толкова повече места или атоми са на разположение за участие в химическа реакция.
Най-често елементи или вериги се добавят към един от присъстващите въглероди или част от основната верига се отделя, за да се генерира различно органично съединение.
Тъй като такива реакции са бавни, се използват катализатори, които са химически агенти за ускоряване на реакциите. В някои случаи Catalyst е фина мрежа от платинен метал.
Примери за неорганични молекули
Натриев хлорид NaCl
Калиев хлорид KCl
Амониев хлорид NH4Cl
Натриев нитрат NaNO3
Калиев нитрат KNO3
Амониев нитрат NH4НЕ3
Сярна киселина Н2ЮЗ4
Фосфорна киселина Н3PO4
Фосфорна киселина Н3PO3
Солна киселина HCl
Йодна киселина HI
Натриев хидроксид NaOH
Калиев хидроксид KOH
Амониев хидроксид NH4О
Калциев хидроксид Ca (OH)2
Магнезиев хидроксид Mg (OH)2
Железен хидроксид Fe (OH)2
Железен хидроксид Fe (OH)3
FeS железен сулфид
Железен сулфат FeSO4
Железен сулфат Fe2(SW4)3
Примери за органични молекули
Глюкоза С6З.12ИЛИ6
Метан СН4
Етан С2З.6
Ацетилен С2З.2
Пропан С3З.8
Бутан С4З.10
Етанол С2З.6ИЛИ
Захароза С12З.22ИЛИ11
Метанол СН4ИЛИ
Глицерол С3З.8ИЛИ3


