Определение на молекулярната геометрия
Miscellanea / / January 11, 2022
Концептуална дефиниция
Това е структурата на молекулата, която определя триизмерното подреждане на атомите, които я изграждат в пространството.

Инженер-химик
Молекулните геометрии в момента се дефинират въз основа на теория на отблъскване на електронни двойки на слоя Валенсия (TRPECV). Тази теория позволява да се предвиди поведението химически на вещества (по-специално ковалентни) и помага да се разбере разпределение електроника, което води до геометрия от молекула. Това от своя страна ни позволява да разберем много от свойствата, които придобиват веществата.
Тази теория се основава на поредица от фундаментални стълбове, които ще прегледаме и след това ще се опитаме да разберем техните приложение практика. На първо място, свързаните и несвързаните (валентни) електрони се разглеждат като море от електрони, което чрез притежават същия тип заряд, те се отблъскват един друг, така че винаги ще бъдат разположени възможно най-далеч от централния атом на молекула.
Второ, това „море“ от електрони или „електронен облак“ образува области с висока електронна плътност, които са съставени в връзки, където електроните са споделени или в двойки електрони, които не са споделени. От своя страна връзките, които се образуват, могат да бъдат единични, двойни или дори тройни.
И накрая, за реши молекулярната геометрия е много полезно да имаме структурата на Люис, където количеството на електронните плътности около централния атом ще бъде преброено и това ще даде индикация от името на нейната геометрия и формата, която молекулата приема триизмерно.
Трябва да се отбележи, че тези плътности ще бъдат разположени възможно най-далеч една от друга, за да се приеме най-стабилната структура и където има по-малко отблъскване. По този начин първо се идентифицира електронната геометрия и след това молекулярната геометрия.
Шест нива на плътност
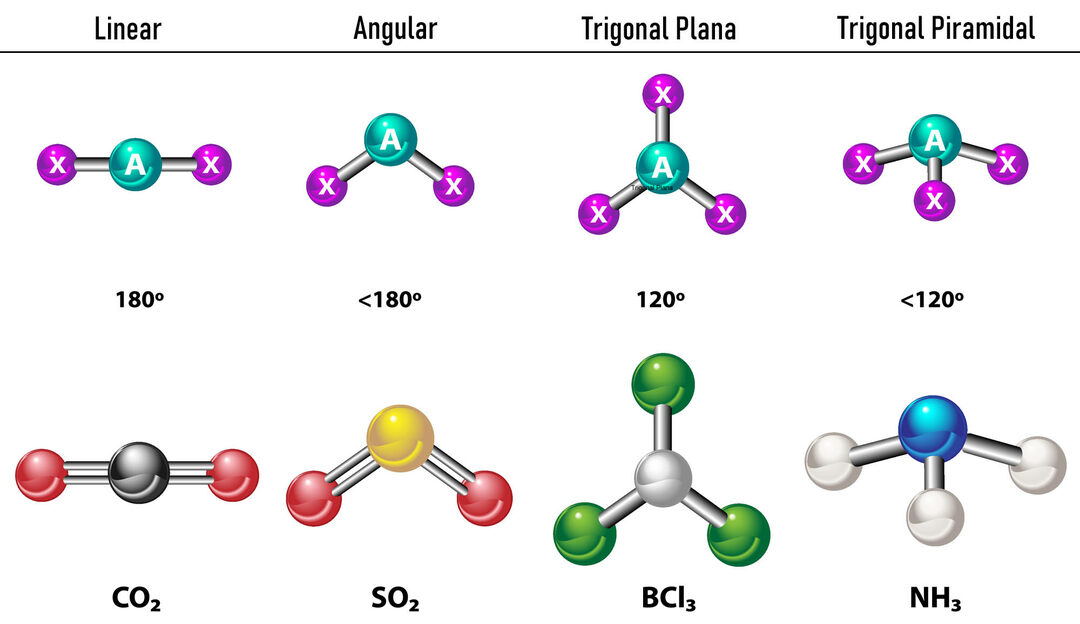
В случай, че има две електронни плътности около централния атом, връзките ще бъдат разположени толкова далеч една от друга между тях, тоест на 180º един спрямо друг и следователно тяхната електронна геометрия е линейна и молекулярно също е линейна.
В случай, че има три електронни плътности около централния атом, има два варианта: три връзки или две връзки и една несвързана двойка. Ако има три връзки, електронната геометрия е такава Тригонална плоскост, с ъгли от 120º между връзките и молекулярната геометрия носи същото име. Сега, ако има несвързана двойка, те се отблъскват един друг с повече интензивност че свързаните заряди следователно са склонни да компресират ъглите на връзката. Ъгълът между свободната двойка и всяка връзка е 120º, а електронната геометрия е тригонална равнина, докато молекулярната геометрия е ъглова.
В случай, че около централния атом има четири електронни плътности, електронната геометрия е тетраедрична. Ако и четирите двойки електрони са свързани, тяхната молекулярна геометрия съвпада по име с електронната им геометрия и ъгълът на свързване е 109,5º. Сега, ако една от двойките е свободна, ъгълът на свързване става по-малък (107º) и молекулярната геометрия е тип Тригонална пирамида. И накрая, ако две са свободни двойки и две са свързани, ъгълът на връзката е 104,5º, докато молекулярната геометрия се нарича Ъглова.
Когато електронните плътности около централния атом възлизат на пет, това се нарича а Тригонална бипирамида неговата електронна геометрия. Ако всички натоварвания са свързани, има ъгли от 120ºC между екваториално разположените връзки и 90º между аксиалните с еквиаторните. Сега молекулярната геометрия се нарича още тригонална бипирамида, докато, имайки четири свързани двойки и една свободна двойка, молекулярната геометрия е изкривена, образувайки добре познатото "рокер“, Там е името, което придобива Изкривен тетраедър. Докато, ако две от петте двойки електрони са свободни и три от тях са свързани, той има „Т”-образна геометрия и името му се дължи именно на неговата структура. И накрая, ако е обратното, три свободни двойки и два свързани заряда, молекулярната геометрия е линейна.
И накрая, около централния атом има шест електронни плътности и се образува октаедър, откъдето идва и името му в електронната геометрия. По същия начин молекулярната геометрия се наименува, ако всички нейни двойки са свързани. Ако имате пет свързани двойки и една свободна двойка, молекулярната геометрия е пирамида с квадратна основа. Ако имате четири свързани двойки и две свободни двойки, молекулярната геометрия е такава Квадратна плоскост.
Фигура: Сладка природа
Теми по молекулярна геометрия
