Концепция в дефиниция ABC
Miscellanea / / April 22, 2022
дефиниция на понятието
Азеотропите са смеси от химични съединения с определен състав, които кипят при определени температури. Основната характеристика е, че сместа се държи така, сякаш е едно чисто вещество, запазвайки свойствата си и осигурявайки лесна работа.

Инженер-химик
Сместа може да се дава от два или повече компонента и неговите композиция той е един и същ както в течната фаза, така и в газовата фаза, това генерира прилики с чистите вещества. От това лесно се заключава, че тази смес не може да бъде разделена на нейните компоненти чрез процеси като напр фракционни дестилации, тъй като, както бе споменато по-горе, той ще запази своите пропорции, като се държи така, сякаш е единичен съставна част.
Друга характеристика е, че точката на кипене на тази смес може да бъде по-висока, по-ниска или дори равна на тази на един от нейните компоненти. Когато азеотропът заври при а температура на максимално кипене, той е известен като максимален азеотроп и когато го прави при възможно най-ниската температура, е известен като минимален азеотроп. Това означава, че минималният азеотроп има по-ниска точка на кипене от чистите му компоненти и обратно с максималния азеотроп. Например, в сместа метанол - бензен азеотропът е минимален (0,61 бензен - 0,39 метанол във фракции моларен) чиято точка на кипене е 58 °C, в резервоар, където точката на кипене на бензола е 80 °C и тази на метанола 65°C
Минимални и максимални азеотропи
Сега... откъде идва азеотропът? Когато има отклонение от закон Raoult, тоест парното налягане на азеотропната смес не е пряко свързано с нейната моларна фракция, когато възниква концепцията за азеотропна смес. Тези отклонения възникват, когато компонентите значително се привличат или отблъскват взаимно, тоест междумолекулните сили са много различни в различните съединения.
Когато отклонението е положително, имаме минимален азеотроп, докато ако отклонението е отрицателно, имаме максимален азеотроп. За да разберем по-добре тази концепция, нека разгледаме някои графики:
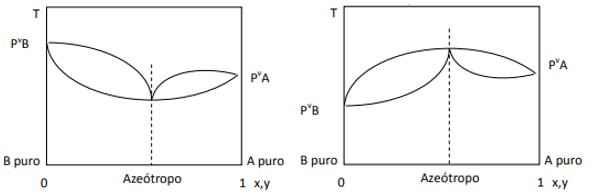
Тук забелязваме, че ако сместа е идеална, съгласно закона на Раул, наляганията на парите на чистите компоненти трябва да се съединят с права линия, тъй като добре, има отклонение от този закон, което причинява образуването на минимални и максимални азеотропи, в зависимост от това дали има по-голям или по-малък афинитет между компоненти. Когато отклонението от закона на Раул е отрицателно, както е на фигурата вляво, то е минимум при диаграма на налягането, но максимум в температурната диаграма (следователно азеотроп на максимума). От друга страна, ако отклонението е положително спрямо закона на Раул, то ще бъде максимум в налягането спрямо. състав, но минимум в диаграмата температура спрямо. състав (тук имаме минимален азеотроп). Не бъркайте диаграмите налягане срещу. състав и температура спрямо композиция.
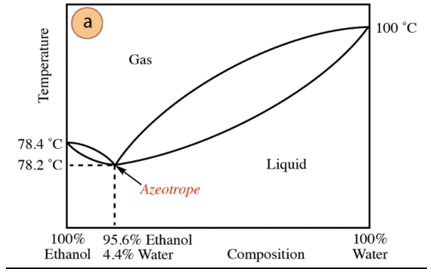
В случай на сместа етанол-вода има минимален азеотроп, чийто състав е 95,6% етанол и 4,4% вода. Температурата на кипене на азеотропната смес е 78,2 °C по-ниска от тази на чистите компоненти. Така че, да предположим, че дестилираш смес вода-етанол с високо съдържание на вода (близо до 100%). Няма да е възможно да се получи чист алкохол, тъй като във всеки етап на дестилация ще се получават по-големи фракции. на етанол, но никога не достига 100%, постепенно ще се доближи до състава на азеотропната смес (най-ниската точка под). Ето защо, подобно на водата, той има склонност да образува минимални азеотропи с органични съединения (предвид вида на междумолекулните сили, които взаимодействат), е необходимо предварително да се отстрани водата от сместа, за да се получи чистото съединение. Или, след като се получи азеотропът, методи за извличане на допълнителна вода.
Въз основа на горното не е случайно да се намери алкохол (в супермаркета и аптека) на 95% е най-евтиният продукт, който може да се получи. За да се получи чист алкохол, е необходимо азеотропът да се "счупи". техника допълнителни, като например използването на изсушаващи агенти или азеотропни дестилации. Азеотропната дестилация се състои от добавяне на допълнителен компонент към сместа, който действа чрез увличане и чрез взаимодействие с някой от компонентите на сместа (по-висок афинитет) може да бъде отстранен от сместа.
Теми в Азеотропи


