30 примера за алкохоли
Примери / / November 06, 2023
The алкохоли са органични химични съединения които съдържат в своята структура хидроксилната функционална група (-ОН), свързана с въглерод (-С). Групата (- C – OH) се нарича „карбинол“. Някои примери за алкохоли са: метанол, етанол и 1-пропанол.
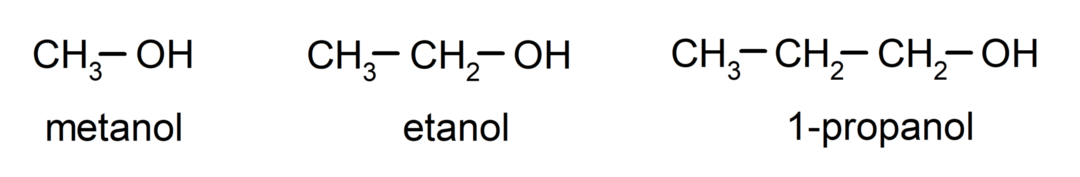
Алкохолите са химични съединения с различни приложения в ежедневието, тъй като имат антибактериални и антисептични свойства. От друга страна, те могат да бъдат опасни за човешкото здраве при неконтролирано поглъщане.
По същия начин не всички алкохоли могат да се приемат от хора.
- Вижте също: Амини и кетони
Видове алкохоли
В зависимост от броя на въглеродните атоми, към които е прикрепен въглеродният атом, който има прикрепена хидроксилна група, алкохолът може да бъде:
- Първичен алкохол. Въглеродният атом, към който е прикрепена хидроксилната група, също е прикрепен към един въглероден атом. Например:
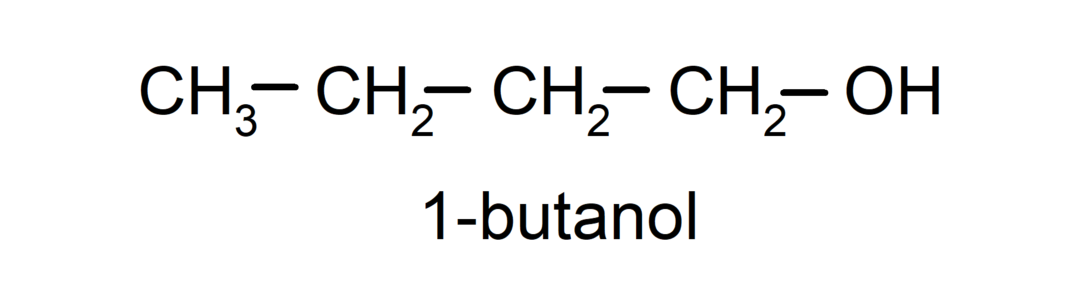
- Вторичен алкохол. Въглеродният атом, към който е прикрепена хидроксилната група, също е свързан с два други въглеродни атома. Например:
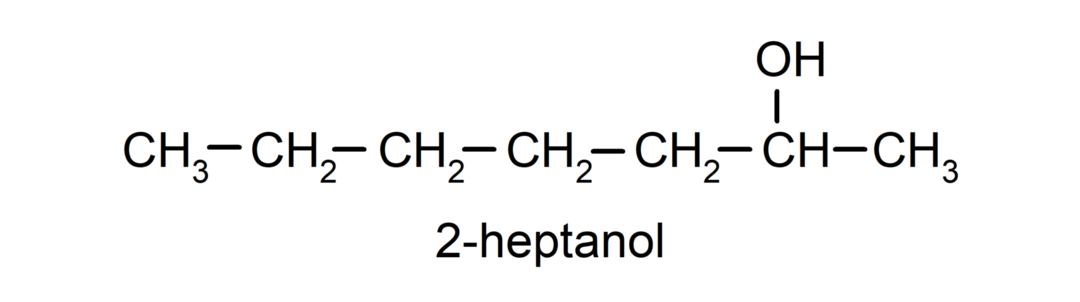
- Третичен алкохол. Въглеродният атом, към който е прикрепена хидроксилната група, също е прикрепен към три въглеродни атома. Например:
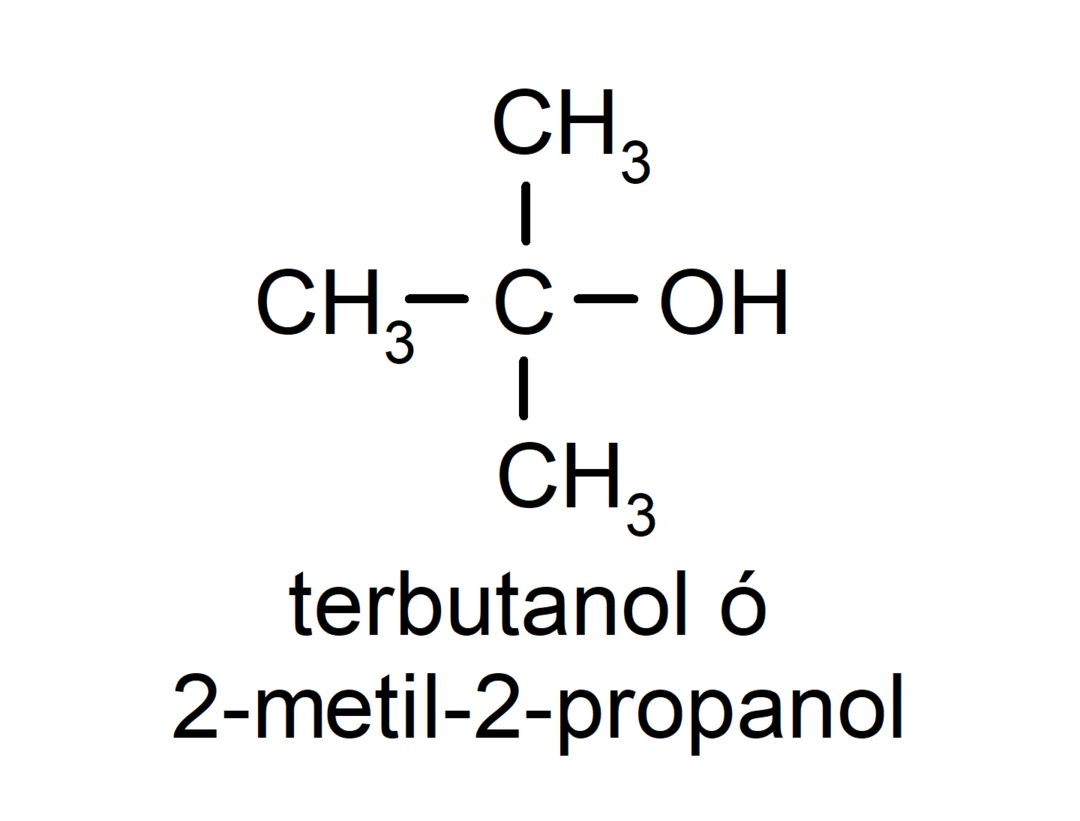
В зависимост от броя на хидроксилните групи, които има, алкохолът може да бъде:
- диол. Той има две хидроксилни групи в своята структура. Например:
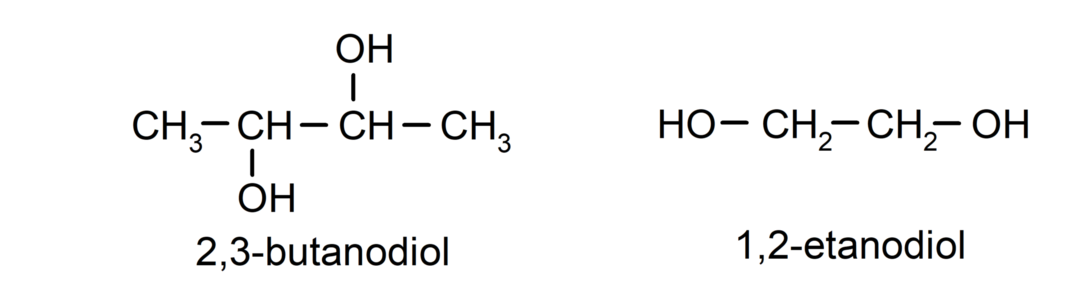
- Триол. Той има три хидроксилни групи в своята структура. Например:
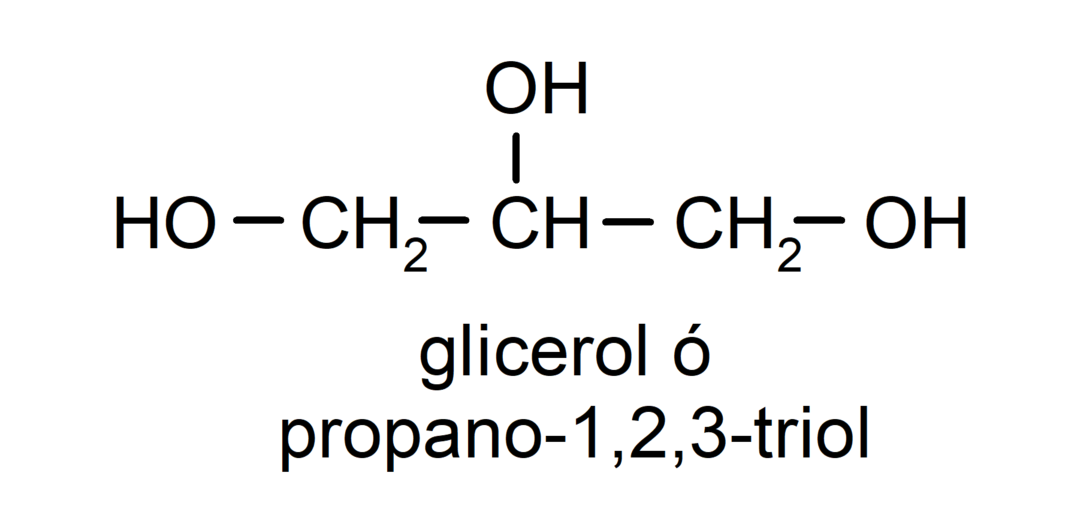
- Полиалкохол. Той има много хидроксилни групи в своята структура. Например:
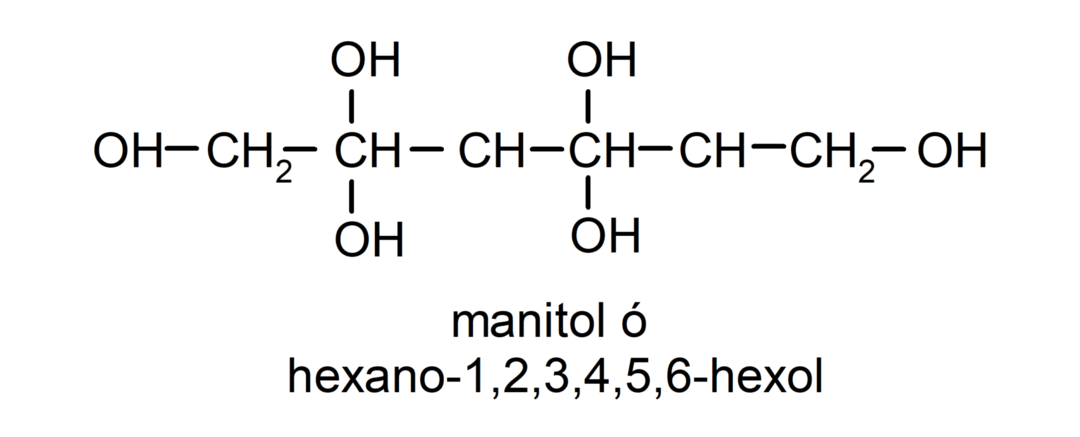
Физични свойства на алкохолите
Някои от физичните свойства на алкохолите са:
- Точка на кипене. Точката на кипене в алкохолите е доста висока поради наличието на хидроксилна група, която позволява образуването на водородни връзки. Освен това, колкото повече хидроксилни функционални групи присъстват във въглеродната верига, толкова по-висока е Точка на кипене на алкохоли.
- Полярност. Алкохолите са доста полярни съединения.
- Разтворимост. Алкохолите с ниско молекулно тегло са разтворими във вода. От друга страна, колкото по-голяма е въглеродната верига на алкохолите, толкова по-ниска е тяхната разтворимост във вода. Освен това, колкото повече хидроксилни групи имат алкохолите, толкова по-голяма е тяхната разтворимост във вода.
- Агрегатно състояние. Повечето алкохоли са течни при стайна температура (25ºC) и имат характерни миризми.
Химични свойства на алкохолите
Някои от химичните свойства на алкохолите са:
- Алкохолите се държат като киселини и основи.. Тяхното поведение като киселини може да се види при реакции с активни метали за освобождаване на водороден газ и образуване на алкоксиди.

Тяхното поведение като основи може да се види в реакции като реакцията на метанол с бромоводород за образуване на метилоксониев бромид.
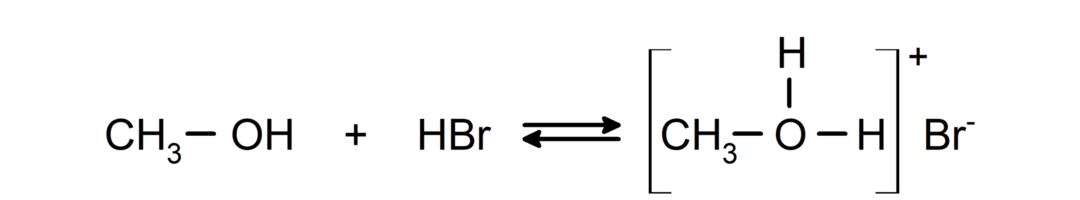
- Алкохолите претърпяват реакции на халогениране. Те реагират с водородни халогениди, за да образуват алкил халогениди.
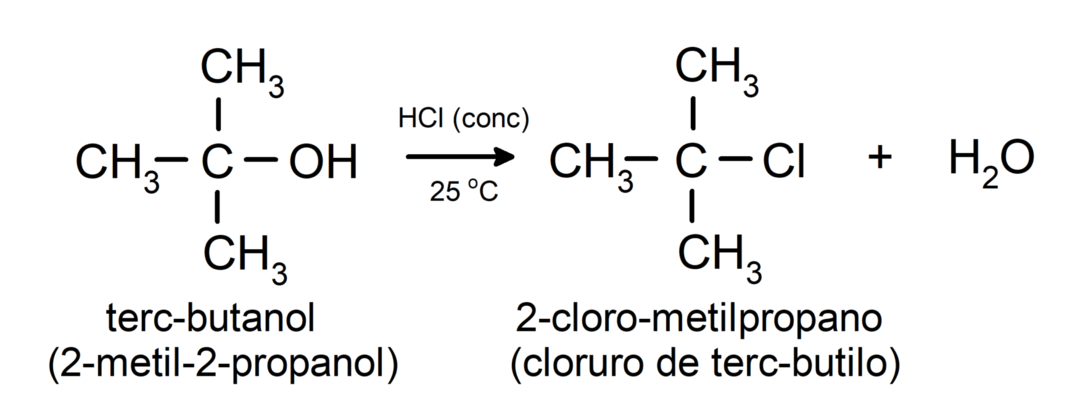
-
Алкохолите претърпяват окислителни реакции когато реагират с определени окислителни съединения. Продуктите от окислителните реакции зависят от вида на алкохола, който реагира, тоест дали е първичен, вторичен или третичен.
Окисляване на първичен алкохол до образуване на алдехид или карбоксилна киселина.
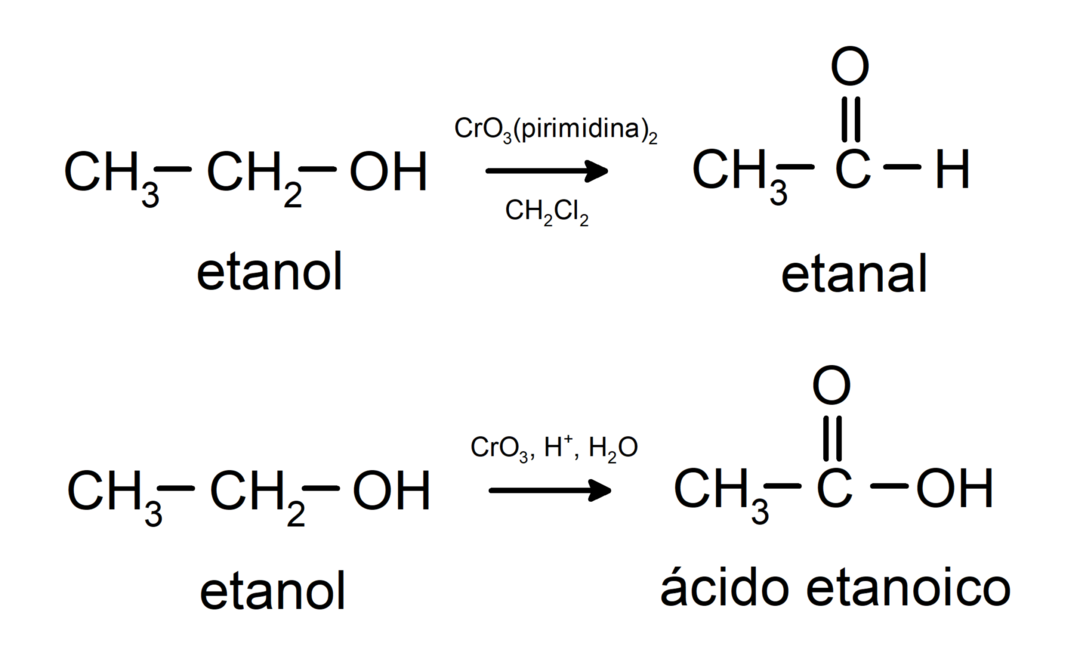
Окисляване на вторичен алкохол до образуване на кетон.
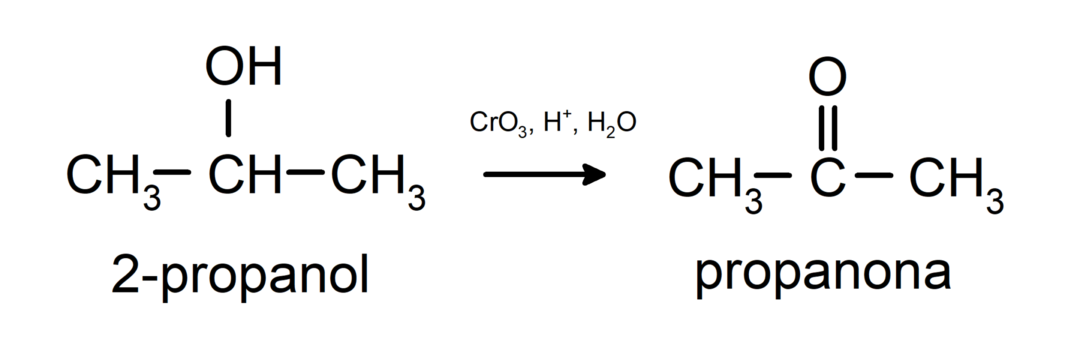
Третичните алкохоли не се окисляват с обикновени окислители. С много силни окислители те могат да бъдат трансформирани в алкени, които след това могат да бъдат окислени.
Алкохолите, които имат две хидроксилни групи, разположени върху съседни въглеродни атоми, се окисляват с оловен тетраацетат, за да образуват два кетона.
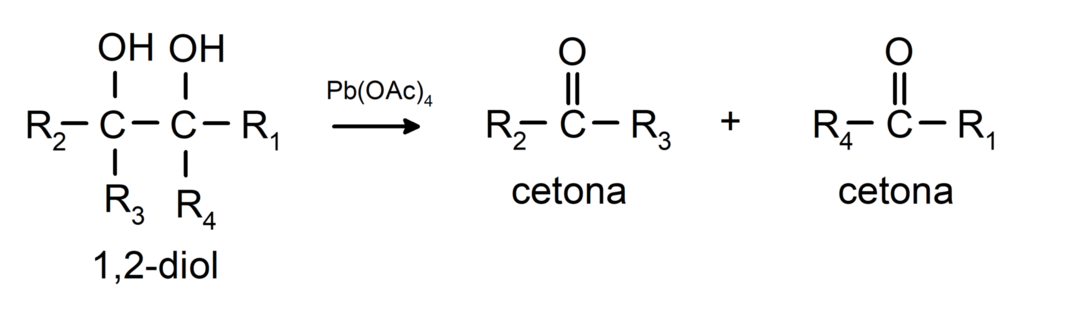
- Алкохолите претърпяват реакции на дехидрогениране. Тези реакции протичат само с първични и вторични алкохоли, които, когато са подложени на високи температури в присъствието на катализатори, отделят водород.
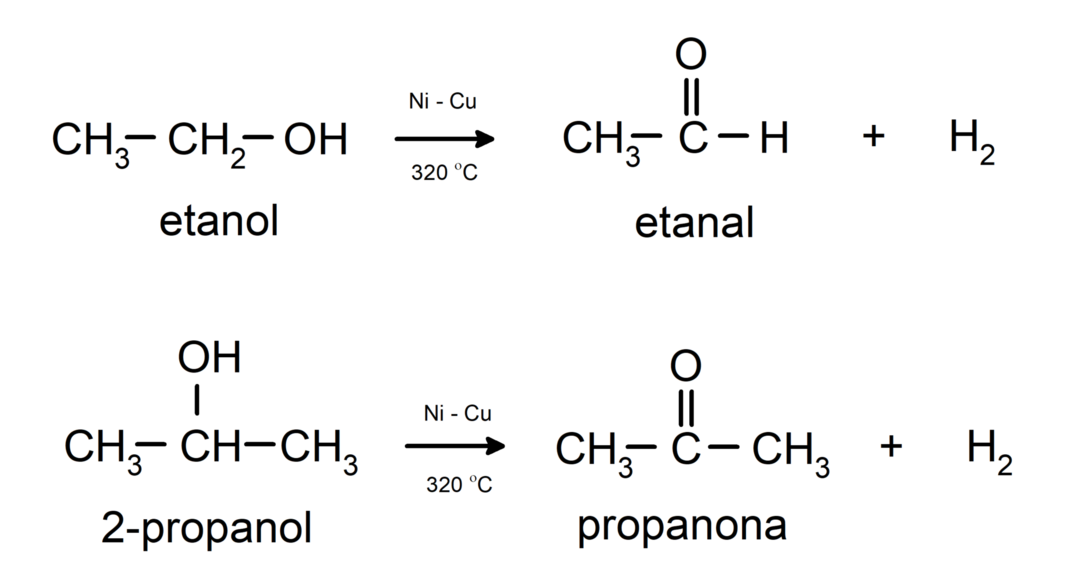
- Алкохолите претърпяват реакции на дехидратация. Алкохолите се дехидратират, за да образуват съответните алкени. Тази реакция протича в присъствието на киселина и междинни температури.
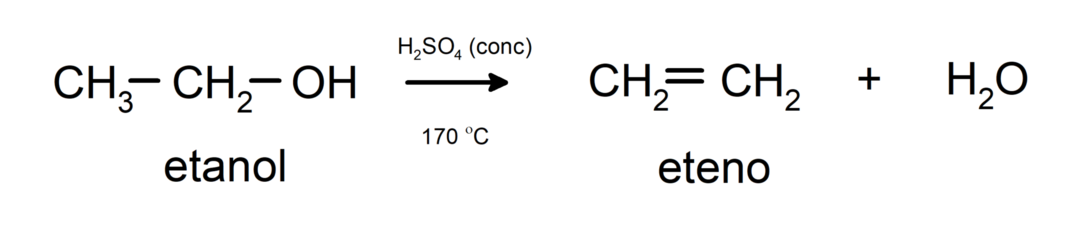
Алкохолна номенклатура
Съгласно номенклатурата, установена от IUPAC (Международен съюз за чиста и приложна химия), алкохолите се наименуват съгласно следните правила:
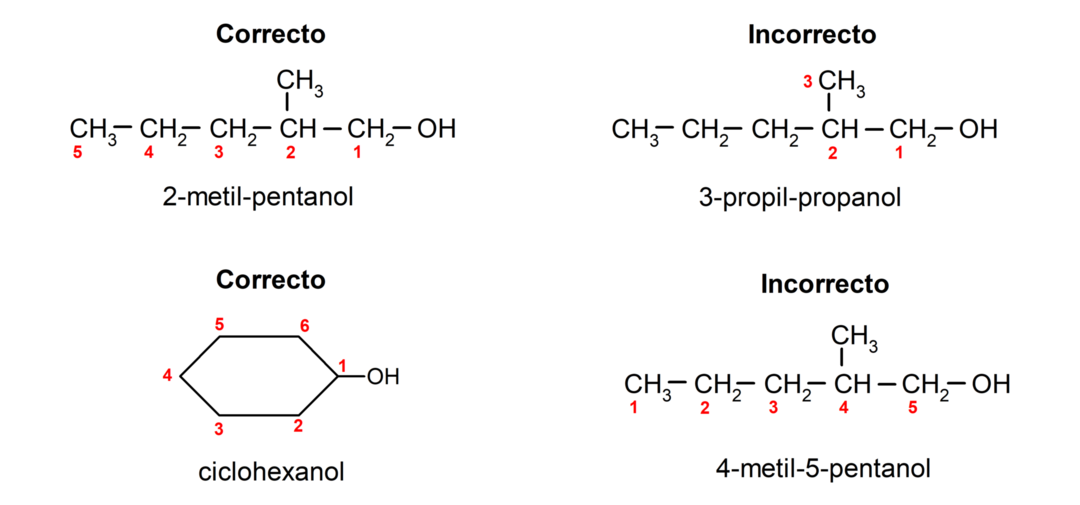
- Позицията на хидроксилната група се избира, като се има предвид, че тя заема най-ниския възможен номер във въглеродната верига. Ако структурата на алкохола е циклична, позицията 1 на въглерода, към който е прикрепена хидроксилната група, се взема предвид и префиксът цикло- се използва за нейното име.
- Името на алкохола се изписва с помощта на префикси, които показват броя на атомите във въглеродната верига, и в допълнение се поставя суфиксът -ol.
- Ако структурата на алкохола има разклонения, най-дългата верига, която също съдържа хидроксилната група, се избира като основна въглеродна верига.
Според традиционната номенклатура алкохолите се наименуват, като се напише думата „алкохол“ и след това името на алкохола. алкан, съответстващ на въглеродната верига, но вместо да се използва окончанието -ан на алкана, окончанието -иличен.
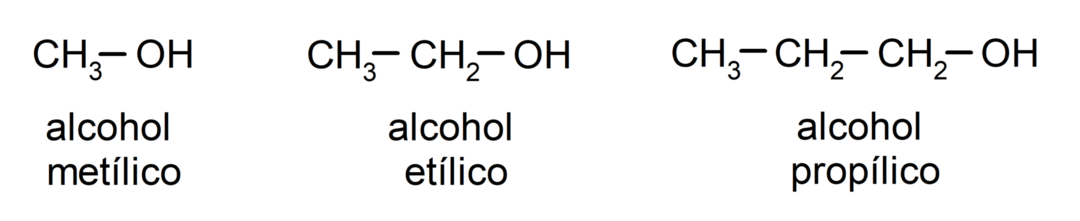
Примери за алкохоли
- метанол
- етанол
- 1-пропанол
- 2-пропанол
- 1-бутанол
- 3-етилхексан-2-ол
- глицерол
- фенол
- 2-метил-2-бутанол
- 1,2-етандиол
- 1,5-хептадиен-3-ол
- 3-метил-2-бутанол
- бензилметанол
- 3-пентанол
- 2-метилфенол
- 1,2-дихидроксифенол
- циклохекснол
- 1-фенилетанол


Употреби на алкохоли
Най-честите употреби на алкохол са:
- Използват се като дезинфектанти и антисептици, тъй като спират растежа на някои микроорганизми или ги унищожи. За тази цел най-често се използват етанол и изопропилов алкохол.
- Използват се при синтеза на различни химични съединения. Метанолът например се използва за получаване на метанал (формалдехид).
- Те се използват за производство на антифриз. Метанолът е един от най-използваните за тази цел.
- Използват се като разтворители във фармацевтичната индустрия. Етанолът е един от най-използваните в този смисъл.
- Използват се като разтворители за лакове, багрила и мастила. Метанолът се използва широко за тази цел.
- Те се използват като гориво и има важна тенденция за частично заместване на използването им изкопаеми горива чрез използване на гориво биоетанол.
- От тях се правят смоли. В този смисъл се използва фенол.
Опасности от консумацията на алкохол
Въпреки че днес консумацията на алкохол е социално приета, злоупотребата с това вещество създава зависимост и пристрастяване.
Етанолът е алкохолът, присъстващ в алкохолните напитки, който при прекомерна консумация влияе когнитивните способности и може да причини сърдечно-съдови заболявания, цироза на черния дроб и рак.
Освен това, когато се достигне степента на алкохолно опиянение, тоест състояние на пиянство, ако дозата на алкохолът е твърде висок, може да настъпи алкохолна кома, която може да доведе до парализа на дишането и дори смърт. смърт.
Препратки
- T. ДА СЕ. Гайсман. (1974) „Принципи на органичната химия“, второ издание. Редакция Reverté, S.A. ISBN: 8429171800
- Ахумада-Кортес, Дж. Г., Гамес-Медина, М. E. & Valdez-Montero, C. (2017). Консумацията на алкохол като проблем на общественото здраве. Ра Ксимхай, 13(2), 13-24.
- Морисън, Р. Т. и Бойд Р. Н. (1998). Органична химия. Образование на Пиърсън.
- Вайнингер, С. J. & Stermitz, F. Р. (1988). Органична химия. Обърнах се.
Следвайте с:
- Етилов алкохол
- Горива
- органична химия



