30 примера за двоични продажби
Примери / / November 09, 2023
The бинарни соли (неутрални соли) се образуват, когато метал и неметал се комбинират. са химични съединения съставен само от две химически елементи. Например: натриев хлорид (NaCl) и калиев бромид (KBr).
- Вижте също: Метали и неметали
Примери за бинарни соли
- Натриев хлорид (NaCl)
- Железен (II) хлорид (FeCl2)
- Железен (III) хлорид (FeCl3)
- Кобалтов (II) сулфид (CoS)
- Кобалтов (III) сулфид (Co2да3)
- Оловен (II) сулфид (PbS)
- Оловен (IV) сулфид (PbS2)
- Калциев хлорид (CaCl2)
- Натриев флуорид (NaF)
- Литиев хлорид (LiCl)
- Стронциев хлорид (SrCl2)
- Бариев хлорид (BaCl2)
- Алуминиев хлорид (AlCl3)
- Магнезиев сулфид (MgS)
- Рубидиев хлорид (RbCl)
- Калциев бромид (CaBr2)
- Калиев сулфид (K2С)
- Магнезиев бромид (MgBr2)
- Цинков сулфид (Zn2С)
- Литиев бромид (LiBr)
- Никелов хлорид (NiCl2)
- Уран(III) хлорид (UCl3)
- Сребърен бромид (AgBr)
- Сребърен йодид (AgI)
- Калиев бромид (KBr)
Номенклатура на бинарните соли
Според традиционната номенклатура бинарните соли се наименуват чрез изписване на името на неметалния елемент с окончанието -ide. От друга страна, името на металния елемент се изписва според степента му на окисление:
- За най-ниска степен на окисление се изписва с окончание -oso. Например: железен хлорид (FeCl2), където желязото има степен на окисление 2+.
- За най-висока степен на окисление се изписва с окончание -ico. Например: железен хлорид (FeCl3), където желязото има степен на окисление 3+.
Според систематичната номенклатура бинарните соли се наименуват чрез изписване на името на неметалния елемент с префикс, който показва количеството на атоми от този елемент в съединението. Освен това окончанието -uro се поставя в името на неметалния елемент. След това се поставя името на металния елемент. Например: магнезиев дихлорид (MgCl2) и железен трихлорид (FeCl3).
Според номенклатурата на Stock бинарните соли се наименуват чрез изписване на името на неметалния елемент с окончанието -ide. След това името на металния елемент се поставя последвано от степента му на окисление, изписано с римски цифри и в скоби. Например: железен (II) хлорид (FeCl2) и кобалтов (III) сулфид (Co2да3).
Приложения на бинарни соли
- Използват се като хладилни агенти в хранително-вкусовата и фармацевтичната промишленост. Например: калциев хлорид (CaCl2).
- Използват се за обработка на метални повърхности срещу корозия. Например: натриев флуорид (NaF).
- Използват се за регулиране на влажността в хартиената и строителната индустрия. Например: калциев хлорид (CaCl2).
- Те се използват в стъкларската промишленост за отстраняване на примеси. Например: силициев тетрахлорид (SiCl4).
- Те се използват като съставки за готвене. Например: натриев хлорид (NaCl).
Физични свойства на бинарните соли
- Те имат високи точки на топене, защото са съставени от йонни връзки.
- Те провеждат електрически ток, когато са разтворени или разтопени.
- Най-често срещаните соли имат ниска твърдост.
- Те не са компресируеми.
- Повечето могат да се разтворят във вода.
Как се получават бинарни соли?
Бинарните соли могат да бъдат получени чрез някои от следните химични реакции:
Взаимодействие между метал и неметал. Например: реакцията между натрий (Na) и дихлорид (Cl2) произвежда натриев хлорид (NaCl).
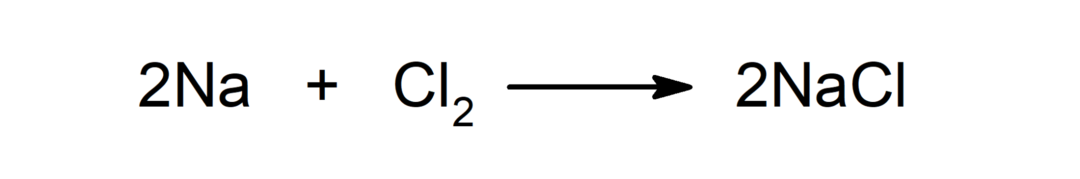
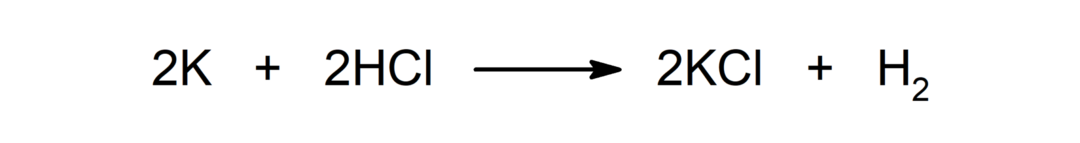
Реакция между метал и киселина. Например: Реакцията между калий (K) и солна киселина (HCl) произвежда калиев хлорид (KCl) и дихидроген (H2).
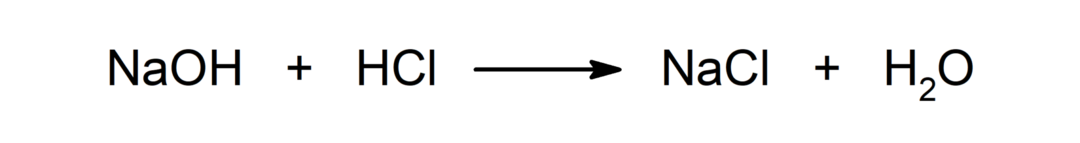
Реакция между киселина и основа. Например: Реакцията между солна киселина (HCl) и натриев хидроксид (NaOH) произвежда натриев хлорид (NaCl) и вода (H2ИЛИ).
Следвайте с:
- оксисоли
- неутрални соли
- киселинни соли
Препратки
- Cerón Villalba, A., Novoa Ramírez, C. С. и Алписар Хуарес, Е. (2020). Номенклатурно видео 1: бинарни соли и химична реакция.
- Акурио Ариас, М. В. и Делгадо Мендес, М. И. (2022). Ръководство за обучение, базирано на игри за „бинарни съединения“ в гимназиалната химия в образователния отдел „Херлинда Торал“ (Бакалавърска теза, НУИ).
- Кабрера, М. Дж. з. (2005). Проучване от първите принципи на електронните и структурни свойства на бинарни и троични съединения (Докторска дисертация, Университет Ла Лагуна).

