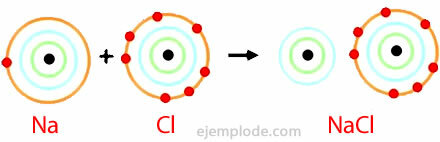
Пример за йонна връзка
Химия / / July 04, 2021
Йонната връзка се дава от наличието на катион и анион, химически видове с електрически заряди с противоположни знаци. Определя се като електростатичната сила, която свързва йони в йонно съединение.
Атомите на елементи с ниска енергия на йонизация са склонни да образуват катиони. За разлика от тях, тези с висок електронен афинитет са склонни да образуват аниони.
Алкалните и алкалоземните метали са по-склонни да образуват катиони в йонни съединения, а халогените и кислородът най-често образуват аниони. В резултат на това съставът на голямо разнообразие от йонни съединения е резултат от комбинацията от група IA или IIA метал и халоген или кислород.
Например, при реакцията между литий и флуор се получава литиев флуорид, отровен бял прах, който се използва за понижаване на точката на топене на спойка и при производството на керамика. Електронната конфигурация на лития е 1s2, 2s1, а този на Флуора е 1s2, 2s2, 2 P5. Когато тези атоми влязат в контакт, валентният електрон 2s1 Литийът се прехвърля към флуорния атом.
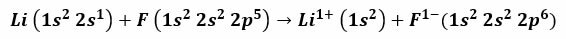
Правилно е да се приеме, че процедурата започва с откъсването на електрона от лития, като йонизира това, за да достигне положителната валентност 1+. Той продължава с приемането на този електрон от флуора, което му дава отрицателен заряд. В крайна сметка образуването на йонната връзка става чрез електростатично привличане. Съединението на литиевия флуор ще бъде електрически неутрално.
Много често срещани реакции водят до образуването на йонни връзки. Например, при изгарянето на калций в кислород се получава калциев оксид:
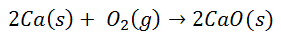
Диатомната молекула кислород се разделя на два отделни атома. Тогава ще има трансфер на два електрона от калциевия атом към всеки кислороден атом. След това и двамата ще имат своите съответни заряди: за калций 2+ за всеки атом и за кислород 2- за всеки атом. При окончателно свързване молекулата на калциевия оксид е електрически неутрална.
Решетъчна енергия на йонни съединения
Със стойностите на йонизационната енергия и афинитета на електроните на елементите е възможно да се предскаже какво елементи образуват йонни съединения, но също така е необходимо да се оцени стабилността на този тип съединения.
Йонизационната енергия и афинитетът на електроните са дефинирани за процеси, протичащи в газовата фаза, въпреки че всички йонни съединения са твърди при 1 атмосфера под налягане и 25 ° C. Твърдото състояние е съвсем различно състояние, защото всеки катион е заобиколен от определен брой аниони и обратно. Следователно общата стабилност на твърдото йонно съединение зависи от взаимодействията на всички йони, а не само от взаимодействието на катион с анион.
Количествена мярка за стабилността на всяко йонно твърдо вещество е неговата решетъчна енергия, което се определя като Енергията, необходима за пълно разделяне на мол от твърдо йонно съединение в неговите йони в газообразно състояние.
Цикъл Born-Haber за определяне на енергията на решетката
Не е възможно директно да се измери енергията на решетката. Ако обаче са известни структурата и съставът на йонно съединение, е възможно да се изчисли енергията на решетката му чрез прилагане на закона на Кулон, който заявява, че потенциалната енергия между два йона е пряко пропорционална на произведението на техните заряди и обратно пропорционална на разстоянието между тях. Да спра.
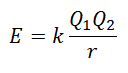
Тъй като зарядът на катиона е положителен, а този на аниона отрицателен, продуктът ще даде отрицателен резултат в енергията. Това представлява екзотермична реакция. Следователно, за да се обърне процеса, трябва да се достави енергия.
Също така е възможно да се определи енергията на решетката индиректно, ако се предполага, че йонното съединение се образува на няколко етапа. Тази процедура е известна като Цикъл Борн-Хабер, който свързва енергиите на решетката на йонните съединения с енергиите на йонизация, електронния афинитет и други атомни и молекулярни свойства. Този метод се основава на закона на Хес за алгебричната сума на химичните реакции и е разработен от Макс Борн и Фриц Хабер. Цикълът на Борн-Хабер дефинира различните етапи, предшестващи образуването на йонно твърдо вещество.

Натриев хлорид
Натриевият хлорид е йонно съединение с точка на топене 801 ° C, което провежда електричество в разтопено състояние и във воден разтвор. Каменната сол е един от източниците на натриев хлорид и се намира в подземни находища, които често са с дебелина няколко стотин метра. Натриевият хлорид се получава също от морска вода или от саламура (концентриран разтвор на NaCl) чрез слънчево изпаряване. Също така, той се среща в природата в минерала, наречен халит.

Натриевият хлорид се използва повече от всеки друг материал при производството на неорганични химични съединения. Световната консумация на това вещество е около 150 милиона тона годишно. Натриевият хлорид се използва главно за производството на други неорганични химични съединения, като хлорен газ, натриев хидроксид, метален натрий, водороден газ и натриев карбонат. Използва се и за топене на лед и сняг по магистрали и пътища.