Пример за химическа енергия
Химия / / July 04, 2021
The Химичната енергия е тази, която идва от химични реакции. Взаимодействието между химичните видове генерира скъсване и / или генериране на връзки, което предполага освобождаване или абсорбиране на енергията, съответно. Химическата енергия се нарича освободена енергия, която може да се използва като топлинна енергия и електрическа енергия например.
Енергия в химични реакции
Химичната енергия може да бъде получена в максималния си израз от два основни източника: горивни и електролитни разтвори. От друга страна, на нивото на човешкото тяло е възможно да се получи енергия чрез химичното разпадане на храната.
Енергия на изгаряне
Например, когато горивото метан СН4, най-простият въглеводород, започва да гори в присъствието на кислородния окислител, той ще се разпадне, образувайки въглероден диоксид CO продукти.2 и вода H2ИЛИ. В допълнение, разкъсването на връзките на водородните атоми с въглеродните атоми ще освободи енергия под формата на топлина.
CH4 (g) + 202 (g) → CO2 (g) + 2Н2 O (l) ∆H = -212,8 Kcal / mol
Уравнение за изгаряне на метан. Топлината на тази реакция се представя чрез ΔH. Отрицателният знак показва освобождаване на Енергия. Реакцията е екзотермична.
 Изгаряне на метанов газ. Реакцията се проявява с пламък.
Изгаряне на метанов газ. Реакцията се проявява с пламък.
Примери за топлини на изгаряне на органични съединения при 25 ° C.
Съединение |
Формула |
ΔH (Kcal / mol) |
Метан (g) |
CH4 |
-212.80 |
Етан (g) |
° С2Н6 |
-372.82 |
Пропан (g) |
° С3Н8 |
-530.60 |
n-бутан (g) |
° С4Н10 |
-687.98 |
н-пентан (g) |
° С5Н12 |
-845.16 |
Етилен (g) |
° С2Н4 |
-337.23 |
Ацетилен (g) |
° С2Н2 |
-310.62 |
Бензен (g) |
° С6Н6 |
-787.20 |
Бензен (л) |
° С6Н6 |
-780.98 |
Толуен (l) |
° С7Н8 |
-934.50 |
Нафталин (и) |
° С10Н8 |
-1,228.18 |
Захароза (и) |
° С12Н22ИЛИ11 |
-1,348.90 |
Метанол (l) |
CH3О |
-173.67 |
Етанол (l) |
° С2Н5О |
-326.70 |
Оцетна киселина (l) |
CH3КОО |
-208.34 |
Бензоена киселина (и) |
° С6Н5КОО |
-771.20 |
За да може горивото да осигури цялата топлина на горене, на която е способно, то трябва да е в газообразно състояние. Както може да се види в таблицата, течният бензен допринася топлина на изгаряне, която е с 6,22 Kcal / mol по-малка от тази, отделяна от газообразния бензен. Това означава, че трябва да се инвестират 6,22 Kcal / mol, за да се премине от течност към газ.
Щракнете за повече информация на Горива.
Електролитични разтвори Енергия
Електролитен проводник е среда, в която участва един или повече йонни видове, което е разпръснати с електрическия си заряд, позволявайки на електрически ток да премине през неговия Конституция. Електролитните разтвори са електролитни проводници.
Електролитните проводници включват, освен електролитни разтвори, Разтопени соли, както и някои твърди соли, като натриев хлорид NaCl и сребърен нитрат AgNO3.
Електронният трансфер се осъществява чрез йонна миграция, положителна и отрицателна, към електродите. Тази миграция включва не само пренос на електричество, но и пренос на материя от една част на проводника в друга.
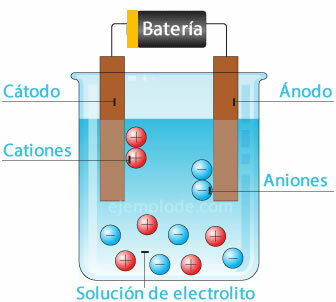 Електрохимична клетка
Електрохимична клетка
Свързване на потенциален източник към металните електроди (катод и анод) и потапянето им в a Воден разтвор, електроните ще пътуват през анода, за да избягат от разтвора до положителния полюс на фонтан. Такъв е случаят, например, с хлориден йон, който се освобождава от своя електрон и вече с неутрален заряд, той се присъединява към друг хлорен атом, за да образува двуатомната молекула. Хлорният газ ще се отдели от разтвора.
2Cl- = 2Cl + 2e-
Електроните, напускащи отрицателния полюс на източника, ще бъдат разположени в потопения катод. Видовете, присъстващи във водния разтвор (йони), ще вземат електроните от катода. Например, водородните йони, които изграждат водата, са били в положителен заряд електрон, който трябва да бъде неутрализиран и свързан с друг водороден атом, за да образува молекулата двуатомен. Той ще избяга като водороден газ от разтвора.
2Н+ + 2e- = 2Н
2Н = Н2 (ж)
Този обмен на електрони може да поддържа работата на автомобилните акумулатори, които се състоят от оловни Pb електроди, потопени в разтвор на сярна киселина Н2ЮЗ4.
Същата енергия се получава във всички видове батерии, които се обработват на домашно ниво: 9V, AA, AAA, D, за да назовем само няколко примера.
Хранителна енергия
Човешките същества усвояват енергията, която се отделя, като дезинтегрират храната, която ядем в тялото си. Тази енергия е това, което тялото ни използва за несъзнателни функции (храносмилане, сърдечен ритъм, клетъчни функции) и тези, които изпълняваме.
Докато нямате интензивна физическа активност и метаболизмът е бавен, препоръчително е да носите редовен прием на калории, тъй като храни с високо съдържание на Сложните липиди и въглехидрати, които имат много големи структури, се разграждат по-трудно, което води до обръщане на Енергия. В този случай ефектът ще бъде моментно противоположен.
Препоръчително е да консумирате плодове, когато трябва да работите през нощта, тъй като плодовете съдържат фруктоза, прост въглехидрат, който лесно се разгражда и ще има енергия на разположение след нас консумация.
Химическа енергия и нейните трансформации
Термоелектрически централи
Тежките горива се използват в термоелектрическите централи, за да имат висока и дълготрайна калоричност. По принцип това е мазут. Изгарянето, което е химическият етап на процеса, ще служи като нагревател за котел, който ще генерира наситена пара. Тази пара ще излезе под налягане през пароразпределителната мрежа и ще започне да движи генераторните турбини. Тези устройства ще произвеждат електрическа енергия, за да доставят съответното население.
Химическа енергия → Механична енергия → Електрическа енергия
Автомобилна операция
Автомобилите зависят от един източник на енергия, който е акумулаторът. В батерията вече е известно, че се появява електролитна проводимост, захранвайки системата за запалване, аксесоарите за таблото и спомагателните контакти. Благодарение на това налично електричество колата ще може да се движи, за да отведе шофьора до желаното място.
Химическа енергия → Електрическа енергия → Механична енергия


