Пример за обемен анализ
Химия / / July 04, 2021
На Аналитична химия, Обемност е метод за анализ, който се състои от Измерване на обема на реагента, необходим за стехиометрична реакция с аналита, което е веществото, което трябва да се определи.
Реагирайте стехиометрично се отнася до веществата, взаимодействащи химически, според пропорция, която маркира химичното уравнение вече балансиран.
Извиква се веществото, което трябва да се изследва Аналит. От това вещество като проба ще бъде взет известен и точно измерен обем, който ще наречем Аликвот, съдържащи се в колба на Ерленмайер за започване на анализа.
Концепции за обемния анализ
Обемен анализ, като вид Химичен анализ, носете включва химическа реакция. Тази химическа реакция ще се проведе между пробата с неизвестно количество от изследваното вещество и известно количество от друго вещество, способно да реагира с първото.
The Реакционните вещества ще бъдат във воден разтвор, и обемите на разтворите, които са взаимодействали, за да достигнат края на реакцията, ще бъдат измерени, което ще бъде видимо благодарение на индикатор, който ще даде цвят вътре в колбата.
В обемния анализ водният разтвор на Известната концентрация се нарича стандартно решение, Стандартен или Титрант, и ще служи като ориентир за завършване на реакцията, за да се направи изчислението, което ще разкрие количеството на изследваното вещество.
Тази процедура за реагиране на двете решения се нарича Химична степен o Оценка, която е основната част на обемния анализ. Състои се от ходене постепенно изливане на стандартния разтвор (Титрант) в аликвотната част (Пример), докато индикаторът покаже промяната с цветова разлика.
A Индикатор Това е химично вещество, което се добавя към Aliquot, показвайки оцветяване и че когато реакцията приключи, ще промени цвета си.
Обемен анализ се състои от проста серия от стъпки:
1. - Приготвяне на стандартен разтвор
2.- Приготвяне на пробата или аликвота
3. - Химична степен
4. - Измерване на обема
5.- Изчисляване на изследваното вещество.
До точката, в която вече са го направили напълно реагира двете вещества, се нарича Точка на еквивалентност.
Както при всеки химичен метод за анализ, и при обемния анализ има изисквания за добри резултати:
-Химичната реакция трябва да бъде СелективнаТоест, стандартното решение ще реагира само с пробата.
-Химичната реакция трябва да бъде Стехиометрични, тоест спазвайте пропорциите, отбелязани в балансираното химично уравнение.
-Химичната реакция трябва да бъде Количествено; се отнася до 99,9% завършеност в точката на еквивалентност.
-Трябва да има откриваема крайна точка в реакцията, което ще бъде по-добре потвърдено от индикатора.
Основен модел
The Основни модели Те са вещества с висока чистота, чиято концентрация в разтвор се изчислява директно от претегленото количество и използвания обем вода.
А) Да, може да реагира с работещи разтвори, за да се знае концентрацията на последните и да се преобразува в стандартни разтвори.
Примери за първични модели са:
-Натриев карбонат (Na2CO3): Използва се за стандартизиране на киселини, като сярна киселина.
-Калиев бифталат: Основният стандарт е да се приготвят стандартни разтвори на основи, като натриев хидроксид.
-Натриев хлорид (NaCl): Използва се за стандартизиране на разтвори на сребърен нитрат.
-Калциев карбонат (CaCO3): Първичен стандарт за EDTA (етилендиамин тетраоцетна киселина).
Основният модел трябва да отговаря на няколко основни характеристики:
Трябва да има Висока чистота, Атмосферна стабилност, Липса на вода за хидратация, Ниска цена и лесна за получаване, Y Високо еквивалентно тегло.
Класификация на обемния анализ
В зависимост от химичния вид, с който работите, за да направите анализ, това ще бъде типът обем:
Обемно-киселинна база: Работи или с киселина, или с основа, за да се анализират проби, които съдържат киселини или основи.
Обем на валежите: Наричан още Аржентометрия, той използва стандартен разтвор на сребърен нитрат, за да определи колко хлориди има в пробата.
Обемен обем: За измерване на концентрацията на твърдост, т.е. калциеви и магнезиеви карбонати, във водата се използва стандартен разтвор на комплексиращ агент, като EDTA.
Обем на REDOX: Реакцията протича между окислително вещество и редуциращо вещество.
Индикатори
От многобройните показатели, използвани в Volumetrics, се открояват три:
1.- Метилов оранжев: Необходимо е оранжево оцветяване в аликвотната част, която ще бъде титрувана с киселина. Когато точката на еквивалентност бъде достигната, индикаторът ще пожълтява.
2.- Фенолфталеин: В началото е прозрачен в аликвотната част, която ще бъде озаглавена с основа. Когато точката на еквивалентност бъде достигната, индикаторът ще стане розов.
3.- Ериохромно черно: Това е индикаторът, използван за определяне на твърдостта във водата. В началото той е лилав в аликвотната част, докато се титрува с комплексиращ агент. В края на реакцията той става син.

Инструменти в обемен анализ
В обемния анализ ще бъдат използвани поредица от инструменти, които, ако не са налични, не могат да бъдат адекватно разработени:
1. - Обемна колба: Това е контейнер като крушка в долната си част, сплескан отдолу, който има тънка колона, в която се добавя течността. Той има знак, който указва къде трябва да бъде менискусът на течността, така че да покрива точния обем. Използва се, за да съдържа стандартни решения; благодарение на точността на неговия обем се осигурява известна концентрация.

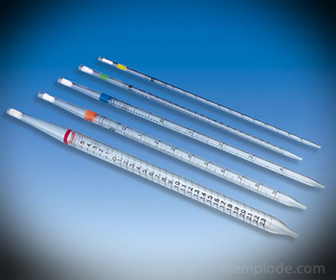
2.- Пипети: Те са градуирани тънки епруветки, които позволяват да се измерват надеждно точните количества течност. Те се предлагат до 25 милилитра и позволяват точно вземане на проби.
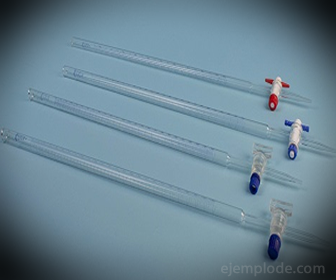
3.- Бюрета: Това е удължена тръба с вместимост 50 милилитра, която ще съдържа стандартния разтвор. В единия си край има клапан за регулиране на потока, който ще отвежда разтвора в аликвотата.
4. - Ерленмайерови колби: Те представляват контейнери с плоска основа, конична форма, която завършва с цилиндричен ръб. Този дизайн ги прави подходящи за химическо титруване, тъй като не позволяват разклащането на разтворите да ги прелее. Ще се изискват минимум три, ако трябва да се правят повтарящи се тестове, за да се гарантира надежден резултат.

Изчисления в обемен анализ
При работа с водни разтвори, важните количества за обемния анализ са концентрация и обем.
Основното уравнение на обема се основава на четири основни данни:
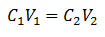
° С1= Концентрация на пробата (неизвестна)
V1= Обем на аликвотната част, с която е работил анализът
° С2= Концентрация на стандартен разтвор, използван за достигане на точката на еквивалентност
V2= Обемен стандартен разтвор, необходим за достигане на края на реакцията
Данните се заместват в уравнението, като само търсената концентрация остава неизвестна. Разбира се, всички данни трябва да са на едни и същи устройства.
Примери за обемен анализ
Определяне на хлоридите (Cl-) чрез аржентометрия, със сребърен нитрат.
Определяне на бромиди (Br-) чрез аржентометрия, със сребърен нитрат.
Определяне на цианиди (CN-) чрез аржентометрия, със сребърен нитрат.
Определяне на магнезиев карбонат (MgCO3), чрез Комплексометрия, с EDTA.
Определяне на калциев карбонат (CaCO3), чрез Комплексометрия, с EDTA.
Анализ на сярна киселина (H2ЮЗ4) с натриев хидроксид (NaOH).
Анализ на натриев хидроксид (NaOH) със солна киселина (HCl).
Определяне на антимона (III) с калиев перманганат (KMnO4).
Определяне на арсен (III) с калиев перманганат (KMnO4).
Определяне на титан (III) с калиев перманганат (KMnO4).
Определяне на молибден (III) с калиев перманганат (KMnO4).
Определяне на желязо (II) с калиев перманганат (KMnO4).
Определяне на оксалатния йон с калиев перманганат (KMnO4).


