Пример за химични основи
Химия / / July 04, 2021
В общата химия, Основите са категория химикали които изпълняват няколко функции:
-Реагирайте с киселини при неутрализация, произвеждащ сол и вода.
-Регулирайте водородния потенциал, pH, повишавайки стойността му, ако те се изсипят в средата, където е намерена реакция.
-Изпълнете като Химически реактиви за голям брой реакции.
Базите могат да бъдат различни видове, и двете Неорганична химия към Органична химия, Като Хидроксиди, Амини и Алкохоли, например.
За да се определи поведението на основите, се използват трите основни теории за киселинните основи: тази на Арениус, Брьонстед-Лоури и Луис.
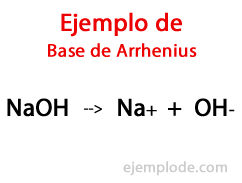
Основите според Арениус
Според шведския химик Сванте Арениус, Основите са тези химични вещества, които осигуряват хидроксилни йони (OH-) към реакционна среда, особено ако това е воден разтвор. По този начин, с наличните хидроксилни йони, ще има Алкално рН, т.е. със стойност по-голяма от 7 и до 14 в зависимост от това колко база присъства в момента на измерване.
Това е една от най-простите и практични теории за прилагане, тъй като няма усложнения за разграничаване на веществата, които участват в реакцията. Добре известно е коя е киселината и коя е основата.
В тази теория има безспорно неорганични хидроксиди, като натриев хидроксид (NaOH) и калиев хидроксид (KOH).
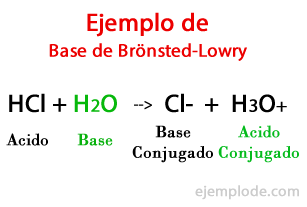
Основите според Брьонстед-Лоури
Според теорията, формулирана от датчаните Йоханес Брьонстед и британските Томас Мартин Лоури, Базата е химичен вид способни да приемат протоните, които друга, Киселината, ще даде по време на химическа реакция. Протонът обикновено е свързан с положителния заряд, който го характеризира, така че можем да го свържем отново с водородни йони (H +).
Когато обменът настъпи в химичната реакция, продуктите се наричат: "Конюгирана киселинна основа" и "Конюгирана основна киселина", на базата на реагентите, които са ги образували.
За тази теория, Амоняк (NH3) е най-представителният случай. За Brönsted и Lowry веществата, които са способни да задържат водородни йони (H +), са основи. В този случай амонякът, като се държи като основа, ще придобие водород в структурата си, консолидирайки се като амониев йон (NH4+), с излишния положителен заряд на водорода. Амонийът е конюгираната амонячна киселина.
Амини, органични съединения, получени от амоняк (NH3), като метил амин (CH3NH2), когато са в разтвор, те се държат като основи и са способни да получават положителни заряди в своята структура, било от водород или карбокация.
Карбокацията е органичен йон, образуван като въглеводородна верига, която при липса на отрицателен йон, която Това може да бъде хидроксил (OH-) или халоген (Cl-, Br-), той има тенденция да се свързва със сайт, който може да го получи, което ще бъде Основа.
Базите според Луис
Американският учен Гилбърт Луис посочи в своята теория за киселинните основи, че основите са тези вещества, които са способни да допринесат своите двойки свободни електрони за друг, за да завърши своя октет.
Тази киселинно-основна теория е допълнение, за да потвърди валидността на своето правило на Октета, в което описва как атомите придобиват стабилност, достигайки брой осем електрона в последната си обвивка, използвайки връзката Ковалентен
Хидроксилният йон е добър пример за основа на Луис. Той има двойка свободни електрони, до които може да достигне водороден йон, който няма електрони. Ще се образува молекула вода. Така ще се образува октетът за кислорода на молекулата и водородите, които са по-малки атоми, ще имат своите двойки електрони, които ще ги направят стабилни.

Използване на важни бази
The Натриев хидроксид NaOH Обикновено се използва във воден разтвор за почистване на втвърдена мазнина в битови и промишлени печки, като я разтваря ефективно. Използва се и в концентриран разтвор, когато възникнат непредвидени разливи на киселинно вещество, за да се неутрализира.
The Магнезиев хидроксид Mg (OH)2 Използва се в разтвор, наречен "Мляко от магнезия", за разрешаване на киселини, като го неутрализира. Продава се в аптеките.
The Калиев хидроксид KOH Използва се като реагент за осапуняване, превръщайки мазнините в сапун.
The Амоняк NH3 Използва се в газообразната си форма като промишлен хладилен агент, особено в ледогенераторите. Много е опасно да се използва, тъй като дишането на концентрация от 5 милиграма на литър от него във въздуха може да бъде фатално.
Примери за химични основи
Вода H2ИЛИ
Амоняк NH3
Натриев хидроксид NaOH
Калиев хидроксид KOH
Магнезиев хидроксид Mg (OH)2
Калциев хидроксид Ca (OH)2
Алуминиев хидроксид Al (OH)3
Амониев хидрокси NH4О
Железен хидроксид Fe (OH)2
Железен хидроксид Fe (OH)3
Хидроксил йон (OH-)
Хлорид йон (Cl-)
Йон бромид (Br-)
