Пример за номенклатура на органични съединения
Химия / / July 04, 2021
Органичните съединения са молекули, чиято характеристика е, че те са образувани от база от въглеродни молекули и водород, известен също като скелет и в комбинация с други елементи, главно кислород, азот и сяра.
The IUPAC (Международен съюз за чиста и приложна химия, Международен съюз за чиста и приложна химия) е установил общи правила за класификация и номенклатура на органичните молекули, от които обясняваме най-важните.
Въглеводороди
Въглеводородите са най-простите органични молекули, изградени от въглероден скелет и водородни атоми. Има три вида въглеводороди:
Алкани
Те са най-простите, образувани от въглеродни атоми, свързани с прости ковалентни връзки към атомите на водород, с обща формула H = 2n + 2, т.е. водородните атоми са два пъти повече от броя на водородните атоми. въглерод, плюс 2. Неговата номенклатура се формира с цифровите представки met- за 1 въглероден атом, et- за 2, prop- за 3 и but- за 4; от 5 въглеродни атома се използват общите представки pent-, hex-, hept-, oct- и др. Към всички алкани се добавя окончанието -ano.
Пример: CH4: метан; ° С2З.6: етан; ° С4З.10: бутан; ° С6З.14: хексан
Алкени
Те са образувани от въглероден скелет, в който има двойна връзка между въглеродните атоми. Общата му формула е H = 2n, тоест водородните му атоми са два пъти повече от въглеродните атоми. Подобно на алканите, те използват префикси, които показват техния брой въглеродни атоми и в този случай се добавя окончанието -eno. Освен това, в молекулите с повече от три въглеродни атома, въглерод, където се намира двойната връзка, като започва да се брои от въглерода най-близо до е.
Примери: C2З.4: етен; ° С3З.6: пропен; ° С4З.8: бутен, 2-бутен; ° С6З.12: Хексен, 2-хексен (двойна връзка при атом 2), 3-хексен (двойна връзка при атом 3).
Алкини
Алкините съдържат тройна връзка в техните въглеродни атоми. Общата му формула е H = 2n-2, което показва, че молекулата ще съдържа два водородни атома, по-малко от два пъти броя на въглеродните атоми. Към префикса, който показва броя на въглеродните атоми, се добавя окончанието -ino. Както в случая с алкените, споменат е въглеродът, съдържащ тройната връзка, отчитан от най-близката до него.
Примери: C2З.2: етин; ° С3З.4: бакшиш; ° С4З.6: бутин, 2-бутин; ° С6З.12: Хексино, 2-хексен (тройна връзка при атом 2), 3-хексин (тройна връзка при атом 3).
Функционални групи
Функционалните групи са комбинации от атоми, които функционират като йон и заместват водородния атом във формулата на алкан.
Радикали
Алканът без водородния атом се нарича радикал и за да се идентифицира се добавя окончанието -ilo:
Примери CH4: метан - СН3+ метил; ° С2З.6: етан - С2З.5+ етил; ° С4З.10: бутан - C4З.9+ бутил; ° С6З.14: хексан - С6З.13+ хексил.
Комбинация от въглеводороди
Един от случаите, които могат да се случат, е, че два или повече въглеводороди се комбинират в молекула. Въглеводородите, с които се комбинира, се наричат дървесни дървета. В тези случаи основният въглеводород ще бъде този с най-дългата верига и броят на въглерода, където намерени са дървесните дървета, последвани от името на радикала с окончание -il и след това името на въглеводорода база. Номерът ще бъде споменат толкова пъти, колкото дърветата, прикрепени към него. В случай, че дървесните рецесии са от един и същи радикал в различни въглеродни атоми, номерата, разделени със запетаи, ще бъдат посочени, последвани от тире, името на радикала, след това номерата на атомите, към които е прикрепен другият радикал, ако има такива, тире, името на радикала и името на въглеводорода база. В случай че има два радикала, свързани към един и същ въглероден атом, броят ще бъде споменат два пъти. Ако те са различни радикали, то това ще бъде споменато веднъж преди името на всеки радикал; ако радикалите са равни, броят ще бъде споменат два пъти. Ще започнем, като споменем първо най-простите арборесценции (тези с най-малко количество въглерод) и след това тези с най-голямо количество.
Пример: Пентанова молекула с два етанови радикала, прикрепени към въглерод 2 и 3:
2,3-етил пентан. Октанова молекула, пропанов радикал при въглерод 6, метанови радикали при въглероди 4 и 5 и етанови радикали, свързани при въглероди 2, 3 и 4: 4,5-метил-2,3,4-етил-6- пропил -октан.
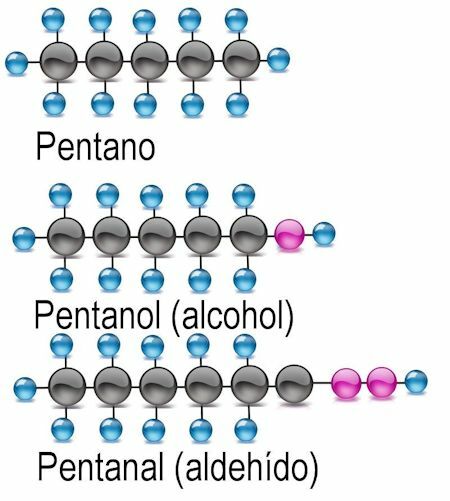
Алкохолна функционална група
Най-простата от функционалните групи е алкохолът, в който водородният атом е заместен с хидроксилна група (ОН). В тези съединения към името на радикала се добавя окончанието -anol. Когато е подходящо, трябва да се спомене въглеродният атом, където се намира функционалната група:
Примери CH3OH: метанол: C2З.5OH етанол; ° С4З.9OH бутанол или 2-бутанол; ° С6З.13ОН хексанол, 2-хексанол (функционална група при атом 2), 3-хексанол (функционална група при атом 3).
Алдехидна функционална група
В алдехидите водородният атом се обменя за функционалната група -CHO. За да ги идентифицира, се добавя окончанието -anal и се споменава и въглеродният атом, където се намира функционалната група:
Примери CH3COH: метанал: C2З.5Етанал COH; ° С4З.9COH бутанал или 2-бутанал; ° С6З.13COH хексанал, 2-хексанал (функционална група при атом 2), 3-хексанал (функционална група при атом 3).
Киселинна функционална група
В органичните киселини водородният атом се обменя за функционалната група -КОО. За да ги идентифицира, се споменава думата киселина и се добавя окончанието -аноична, а също така се споменава и въглеродният атом, където се намира функционалната група:
Примери CH3COOH: метанова киселина: C2З.5COOH етанова киселина; ° С4З.9COOH бутанова киселина или 2-бутанова киселина; ° С6З.13COH хексанова киселина, 2-хексанова киселина (функционална група при атом 2), 3-хексанова киселина (функционална група при атом 3).
