10 Příklady plynových směsí
Různé / / July 04, 2021
Směsi plynné látky Jsou jedny z nejsnadněji dosažitelných, protože je velmi možné, že se látky, které jsou v tomto stavu agregace, mísí. Například: Neonová, argonová a xenonová směs, aerosolový insekticid, vzduch a helium.
Prakticky všechny plyny lze kombinovat neomezeně, samozřejmě některými podmíněné chemické, fyzikální a zásadně související s aspekty bezpečnosti uživatelů, které manipuluje. Stejně jako různé typy směsí, které se vytvářejí mezi látkami, i směsi plyny mají také vlastnosti, které jsou pro ně jedinečné.
Studium šumivé směsi je obvykle stejně užitečné jako u plynů v jejich čistém stavu: stejné znalosti o vzduchu, který je přítomen v atmosféra by byla nemožná, kdyby nebylo znalostí o proporcích a chování směsných plynů.
Tímto způsobem je důležité některé znát funkce směsí plynů, jako je například vlastnost parciálního tlaku (vyvíjeného každým z plynů v směsi) a molární frakce (poměr mezi počtem molů plynné složky a počtem celkových směsí soda). Krtci vyjadřují množství plynu ve směsi.
The Daltonův zákon uvádí, že celkový tlak plynné směsi se rovná součtu parciálních tlaků každého z nich jeden z jednotlivých plynů, které se na něm podílejí (to je způsobeno tím, že plyny nereagují mezi Ano). Parciálním tlakem se zde rozumí tlak, který by vyvíjel každý z plynů, pokud by byl nalezen pouze ve stejné nádobě a za stejných podmínek teplota. A) Ano:
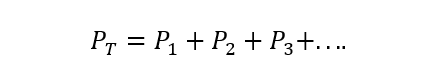
Kde PT je celkový tlak a P1, P2 A str3 jsou parciální tlaky hypotetických plynů 1, 2 a 3 ve směsi plynů.
Pomocí Daltonova zákona byl vyvinut výraz pro výpočet částečný tlak plynu v plynné směsi, pokud známe jeho celkový tlak a jeho molární zlomek.
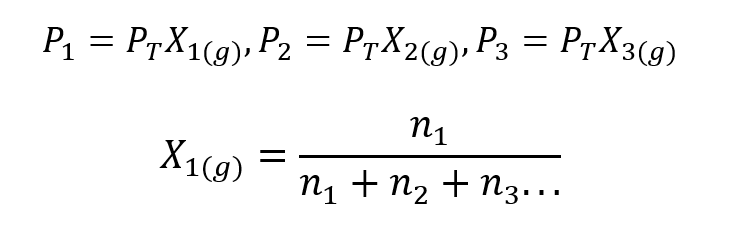
Kde X1, X2 Y X3 jsou molární frakce hypotetických plynů 1, 2 a 3 ve směsi plynů a n1, n2 Y n3 jsou množství látky každého z těchto plynů ve stejné směsi.
Jeden z hlavní vlastnosti složek ve směsích je koncentrace, kterou lze vyjádřit v různých jednotkách. V případě plynných směsí lze koncentraci jejích složek vyjádřit v ppm (části na milion), což je jednotka vztažená na její objem. To znamená, že určité množství ppm složky ve směsi plynů je poměr objemu tohoto určitého množství k objemu každého milionu jednotek směsi.
Je důležité si to uvědomit ppm plynu závisí na teplotě a tlaku plynu. Z tohoto důvodu se k výpočtu ppm plynu obvykle používají normální podmínky tlaku a teploty. (CNPT), které dávají normální stav teplotě 0 stupňů Celsia a 1013 hektopascalech (1 bar) Tlak. Pokud tyto podmínky nejsou použity, musíte určit, které z nich budou použity.
Může vám sloužit:
Příklady směsí plynů
Následující seznam obsahuje směsi plynů se specifikací prvků, které se ve směsi objevují:
- Vzduch (směs 21% kyslíku a 79% dusíku plus další plyny v malém množství)
- Cronigón (směs 99% argonu a 1% kyslíku)
- Trimix (směs kyslíku, dusíku a helia)
- Směs neonů, argonu a xenonů
- Směs 85% metanu, 9% etanu, 4% propanu a 2% butanu.
- Hexafluorid sírový a vzduch
- Aerosolový insekticid
- Vzduch a hélium
- Nitrox (směs vzduchu obohacená kyslíkem a dusíkem)
Postupujte podle:


