20 Příklady chemických jevů
Různé / / July 04, 2021
The chemické jevy (nebo chemické reakce) jsou jevy, ve kterých dochází ke změnám v hmotě a vytvářejí se nové látky zvané „produkty“ a další zvané „reaktanty“ se rozkládají. Například: hniloba dřeva, pálení papíru, kompostování.
Chemické reakce mohou být spontánní (reakce, ke kterým dochází bez potřeby energie nebo katalyzátorů) nebo ne spontánní (reakce, které vyžadují příspěvek energie, katalyzátorů nebo nějakého vnějšího zásahu). Mnohokrát je nutné, aby reakce měla a teplota konkrétní, a pH nastavená hodnota tlaku atd.
Může být také nezbytné kontrolovat rychlost na které dochází k chemickým reakcím. The katalyzátory Jsou to látky, které se přidávají k chemické reakci za účelem zvýšení její rychlosti, zatímco inhibitory jsou látky, které zpomalují rychlost chemických reakcí. Dalšími faktory, které ovlivňují rychlost chemické reakce, jsou teplota, tlak, koncentrace reaktantů a povaha samotné reakce.
Může vám sloužit:
Druhy chemických jevů
Chemické reakce mohou být:
Anorganické reakce. Zasahovat anorganické sloučeniny a lze je klasifikovat podle:
- Smysl, ve kterém k reakci dochází.
-
Reverzibilní reakce. Vyskytují se oběma způsoby, takže produkty se mohou rozkládat a znovu vytvářet reaktanty.
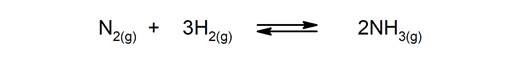
-
Nevratné reakce. Stávají se pouze jedním způsobem.

-
Reverzibilní reakce. Vyskytují se oběma způsoby, takže produkty se mohou rozkládat a znovu vytvářet reaktanty.
- Typ částice, která reaguje.
-
Acidobazické reakce. Dojde k přenosu H iontů+.

-
Oxidačně-redukční reakce. Jeden z reaktantů oxiduje (zvyšuje jeho počet oxidace), zatímco druhý je snížen (jeho oxidační číslo klesá). V těchto reakcích dochází k přenosu elektronů.

-
Acidobazické reakce. Dojde k přenosu H iontů+.
- Rychlost reakce.
-
Rychlé reakce. Vyskytují se ve velmi krátké době.
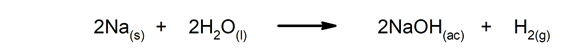
-
Pomalé reakce Dokončení trvá dlouho.
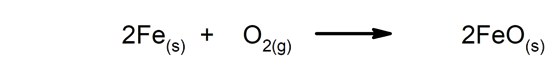
-
Rychlé reakce. Vyskytují se ve velmi krátké době.
- Forma energie, kterou vydává nebo absorbuje.
-
Exotermické reakce. Jak k nim dochází, uvolňují teplo.
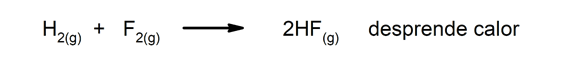
-
Endotermické reakce. Když k nim dojde, absorbují teplo.

-
Exuminiscenční reakce. Když k nim dojde, vyzařují světlo.

-
Endoluminous reakce. K tomu potřebují světlo.

-
Exotermické reakce. Jak k nim dochází, uvolňují teplo.
- Typ transformace.
-
Syntéza nebo adiční reakce. Dvě látky se spojí a vytvoří novou látku.
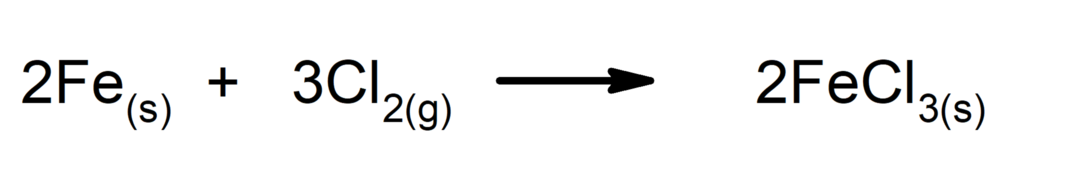
-
Rozkladné reakce. Jedna nebo více látek se rozpadá na své nejjednodušší složky.
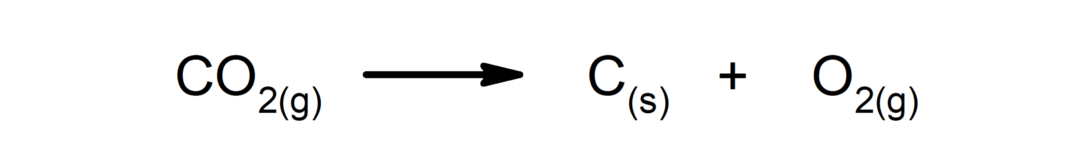
-
Vytěsňovací nebo substituční reakce. Jeden prvek nebo sloučenina nahradí jiný ve sloučenině a uvolní ji.
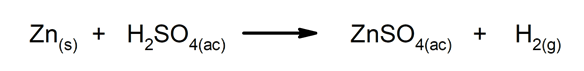
-
Dvojité substituční reakce. Dvě sloučeniny si vyměňují prvky nebo sloučeniny současně.

-
Syntéza nebo adiční reakce. Dvě látky se spojí a vytvoří novou látku.
Organické reakce. Jsou to reakce, při nichž zasahují organické sloučeniny. Mají mnoho klasifikací založených na typu organické sloučeniny, která reaguje, a typu reakce, kterou prochází. Některé příklady jsou:
-
Halogenace alkanů. Vodík je nahrazen a alkanu halogenem.
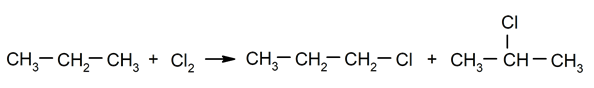
-
Spalování alkanů. Pokud je spalování úplné, alkan reaguje s kyslíkem za vzniku oxidu uhličitého a vody.
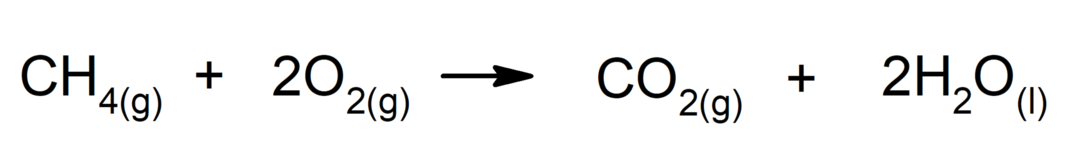
-
Halogenace alkeny. Halogeny jsou substituovány za jeden nebo oba vodíky uhlíků, které jsou zahrnuty v dvojné vazbě.
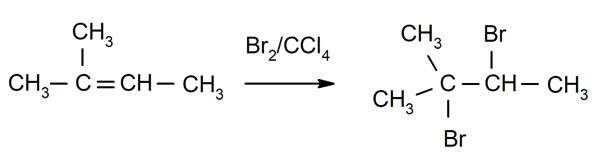
-
Hydrogenace alkenů. K uhlíkům zapojeným do dvojné vazby se přidávají vodíky za vzniku odpovídajícího alkanu.
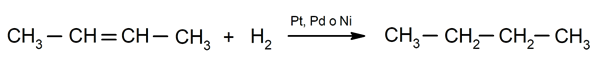
Důležitost chemických jevů
Mnoho chemických jevů udržovat život živých věcí, jako je trávení u lidí a zvířata, fotosyntéza v rostlinách a dýchání v obou.
Další velmi důležitý chemický proces, zejména v životě mikroorganismy, je kvašení, který se obvykle používá při výrobě jídlo jako sýry, jogurty, vína a piva.
Všechny zvýšit a růst a živá bytost Zahrnuje chemické reakce, které v něm probíhají, někdy stimulované určitými podmínkami prostředí.
Příklady chemických jevů
Kolem nás existuje řada případů chemických jevů nebo procesů, které je zahrnují:
- Hniloba dřeva
- Spalování papíru
- Odpor vůči antibiotika bakterie
- Mléko, které kyselne
- Dezinfekce rány pomocí alkohol
- Používání ovocné soli v boji proti pálení žáhy
- Pálení svíčky
- Srážení krve
- Svalová únava po intenzivním cvičení
- Smrt hmyz insekticidy
- Získání sýru rokfort
- Získání jablečného moštu
- Získání jogurtu
- Kompostování
- Ensilage
- Získání bioethanolu z melasy
- Oteklé plechovky
- Zkažené vejce
- Zrezivění roštu
- Získávání bionafty z palmového oleje
Chemické jevy v průmyslu
Určité chemické jevy jsou také klíčem kprůmysl. Za prvé, spalování uhlovodíky (jako je benzín, nafta nebo petrolej) Energie provozovat stroje, které zvládají nespočet průmyslových procesů.
Na druhou stranu ocelářský průmysl, papír, plasty, stavební materiály, barvy, léky, výrobky pro agro atd., jsou založeny na různých chemických jevech, jako je galvanizace, elektrolýza a mnoho dalších ostatní více.
Generace nové zdroje energie (jako bionafta a bioethanol) je také založen na tomto typu jevu.
Transformace energie
V chemických jevech je obvyklé, že existuje transformace energie. Například když se chemická energie obsažená ve vazbách určité molekuly transformuje na elektrickou energii nebo se uvolní jako teplo (k tomu dochází při exotermních jevech, jako je smíchání kyseliny chlorovodíkové se zinkem), dochází k transformaci Energie. Totéž se stane, když je světelná energie zachycena a přeměněna na chemickou energii.
Některé chemické procesy vyžadují ke svému provozu teplo a říká se jim „endotermní“. Jiné vyžadují přítomnost katalyzátorů nebo kofaktorů.

