20 Příklady kyselých solí
Různé / / July 04, 2021
V anorganická chemie soli se nazývají sloučeniny, které se získávají, když a kyselina jeho atomy vodíku jsou nahrazeny kovovými kationty (i když někdy nekovovými kationty, například amonným kationtem, NH4+). V konkrétním případě kyselé soli, vodíky kyseliny jsou částečně substituované, to znamená, že alespoň jeden nesubstituovaný vodík zůstává jako součást soli. V tom se odlišují od neutrální soli, kde jsou vodíky kyseliny zcela substituovány.
The jdete ven se obvykle tvoří reakcí mezi a kyselina a hydroxid (základna). Při těchto reakcích obvykle ztrácí báze své hydroxylové skupiny (-OH) a kyselina je ztrácí. atomy vodík (H), tvořící neutrální sůl; ale pokud dotyčná kyselina zachovává alespoň jeden ze svých atomů vodíku a mění elektrický náboj reakce, získáme kyselou sůl nebo hydrogenovanou sůl.
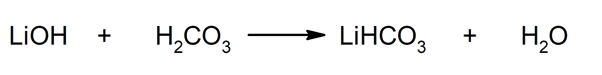
Tak například hydrogenuhličitan lithný a voda se získávají reakcí mezi hydroxidem lithným a kyselinou uhličitou:
Názvosloví kyselých solí
Soli kyselin lze pojmenovat podle tři typy nejběžnější nomenklatura:
Příklady kyselých solí
- Hydrogenuhličitan sodný (NaHCO3). Také se nazývá hydrogenuhličitan sodný (IV), jedná se o bílou krystalickou pevnou látku rozpustnou ve vodě, kterou lze v přírodě nalézt ve stavu minerální nebo může být vyroben v laboratoři. Je to jedna z nejznámějších kyselých solí a je široce používána v cukrářských výrobcích, farmakologii nebo při výrobě jogurtů.
- Hydrogenuhličitan lithný (LiHCO3). Tato kyselá sůl byla použita jako zachycovací činidlo pro CO2 v situacích, kdy je takový plyn nežádoucí, jako v severoamerických vesmírných misích „Apollo“.
- Dihydrogenfosforečnan draselný (KH2PO4). Je to krystalická pevná látka, bez zápachu, rozpustná ve vodě, široce používaná v různých průmyslových odvětvích, jako jsou droždí jídlo, chelatační činidlo, nutriční posilující látka a pomocník při fermentačních procesech.
- Hydrogensíran sodný (NaHSO4). Je to kyselá sůl, která vzniká neutralizací kyseliny sírové. Je průmyslově široce používán při rafinaci kovů a čisticích prostředků. Ačkoli je vysoce toxický pro některé ostnokožce, používá se jako přísada do krmiva pro zvířata a při výrobě šperků.
- Sírovodík sodný (NaHS). Je to nebezpečná sloučenina, se kterou se zachází, protože je vysoce korozivní a toxická. Může to způsobit těžké popáleniny kůže a poškození očí, protože je také hořlavé.
- Hydrogenfosforečnan vápenatý (CaHPO4). Používá se jako doplněk stravy v cereálie pro dobytek. Je to pevná látka nerozpustná ve vodě, ale schopná krystalizovat, když je hydratována spotřebováním dvou molekuly z vody.
- Hydrogenuhličitan amonný ([NH4] HCO3). Také známý jako „hydrogenuhličitan amonný“ se používá v potravinářském průmyslu jako droždí chemie, i když má tu nevýhodu, že zachycuje čpavek a dává jídlu špatnou chuť, pokud se používá v přebytek. Používá se také v hasicích přístrojích, při výrobě pigmentů a pro expanzi gumy.
- Hydrogenuhličitan barinebo (Ba [HCO3]2). Je to kyselá sůl, která při zahřátí může zvrátit svou produkční reakci a je vysoce nestabilní, s výjimkou roztoku. Je široce používán v keramickém průmyslu.
- Hydrogensiřičitan sodný (NaHSO3). Tato sůl je extrémně nestabilní a v přítomnosti kyslíku se uvolňuje do síranu sodného (Na2SW4), a proto se používá v potravinářském průmyslu jako konzervační prostředek a vysoušedlo. Je to extrémní redukční prostředek a běžně používaný člověkem, který se také používá k fixaci barev.
- Citrát vápenatý (AC3[C6H5NEBO7]2). Běžně známá jako hořká sůl, používá se jako konzervační přísada do potravin a jako doplněk výživy, pokud je spojena s aminokyselinou lysin. Je to bílý krystalický prášek bez zápachu.
- Monokalciumfosfát (Ca [H2PO4]2). Je to bezbarvá pevná látka, která se získává reakcí hydroxidu vápenatého a kyseliny fosforečné, široce používaná jako kypřící prostředek nebo jako hnojivo v zemědělských pracích.
- Fosforečnan vápenatý (CaHPO4). Také známý jako monohydrogenfosforečnan vápenatý, má tři různé krystalické formy, které se používají jako přísada do potravin a je přítomen v zubních pastách. Kromě toho se přirozeně tvoří v ledvinových kamenech a v takzvaném „ledvinovém kameni“.
- Fosforečnan hořečnatý (MgH4P2NEBO8). Je to bílá krystalická sůl bez zápachu, částečně rozpustná ve vodě. Používá se při konzervaci potravin jako okyselující látka, jako korektor kyselosti nebo prostředek při léčbě mouky.
- Diacetát sodný (NaH [C.2H3NEBO2]2). Tato sůl se používá jako ochucovadlo a konzervační látka v pokrmech, které zabraňují nebo zdržují vzhled houby a mykobakterie, a to jak ve vakuově balených výrobcích, jako jsou masné výrobky, tak v moučném průmyslu.
- Hydrogenuhličitan vápenatý (Ca [HCO3]2). Jedná se o hydrogenovanou sůl, která pochází z uhličitanu vápenatého a je obsažena v minerálech, jako je vápenec, mramor a další. Tato reakce zahrnuje přítomnost vody a CO2, takže k němu může dojít spontánně v jeskyních a jeskyních bohatých na vápník.
- Fluorid kyseliny rubidiové (RbHF). Tato sůl se získává reakcí kyseliny fluorovodíkové (vodík a fluor) a rubidia, alkalického kovu. Výsledkem je toxická a korozivní sloučenina, se kterou je nutno zacházet opatrně.
- Fosforečnan amonný ([NH4] H2PO4). Je to ve vodě rozpustná sůl vyrobená reakcí amoniaku a kyseliny fosforečné. Obvykle se používá jako hnojivo, protože dodává půdě živiny dusíku a fosforu nezbytných pro růst rostlin. Je také součástí prášku ABC v hasicích přístrojích.
- Hydrogenorthoboritan zinečnatý (Zn [HBO3]). Je to sůl používaná jako antiseptikum a jako přísada při výrobě keramiky.
- Fosforečnan sodný (NaH2PO4). Používá se většinou v laboratořích jako „pufr“ nebo pufrovací roztok, který zabraňuje náhlým změnám pH roztoku.
- Hydrogenftalát draselný (KHP). Také se jí říká „ftalát kyseliny draselné“, jedná se o pevnou a stabilní sůl v běžném vzduchu, a proto se často používá jako primární standard při měření pH. Je také užitečný jako agent vyrovnávací paměti v chemické reakce.
Postupujte podle:

