20 Příklady kyselin
Různé / / July 04, 2021
The kyseliny tvoří důležitou skupinu chemické sloučeniny, velmi široký. Kyseliny jsou obecně definovány jako sloučeniny, které mohou darovat jednu nebo více kationty vodík (H+) na jinou sloučeninu, známou jako základna. I když ve skutečnosti jsou kyseliny definovány podle několika teorií:
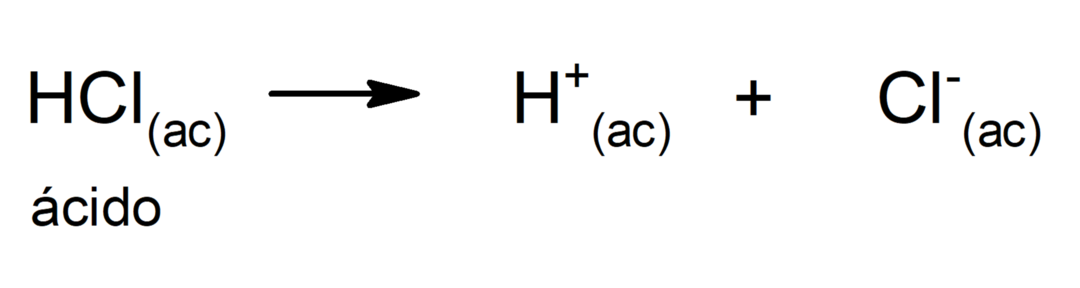 Omezení této teorie spočívá v tom, že kyseliny jsou definovány pouze ve vodném roztoku.
Omezení této teorie spočívá v tom, že kyseliny jsou definovány pouze ve vodném roztoku. 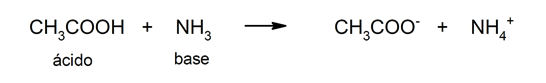

Vlastnost uvolnění vodíkové kationty je to, díky čemuž kyseliny produkují roztoky pH méně než 7. Kyseliny, které mohou uvolňovat více než jeden proton (s tímto názvem pro H+) se nazývají polyprotické nebo polyfunkční.
Vlastnosti kyselin
Pokud jde o jejich vlastnosti, kyseliny mohou být prezentovány jako kapaliny nebo jako plyny, vzácněji jako pevný. Kyselou chuť, kterou můžeme rozpoznat a která charakterizuje tyto sloučeniny, najdeme například v citrusové plody, které jsou bohaté na kyselinu citronovou, nebo ocet, což je kyselý roztok octový. Jedná se o organické kyseliny.
existovat organické a anorganické kyseliny; nejsilnější jsou obvykle anorganické. Mnoho organických kyselin slouží důležitým biologickým rolím. Mezi anorganickými patří kyselina chlorovodíková, která hraje velmi důležitou roli v procesu trávení. The
nukleové kyseliny Jsou také zásadní pro život, protože jsou základem genetického materiálu buňky a obsahují klíč k syntéze protein.Tendence ztráty protonů určuje sílu kyseliny.
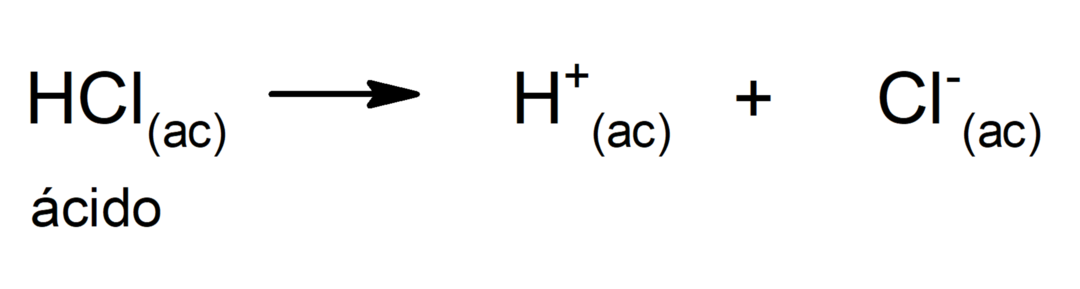
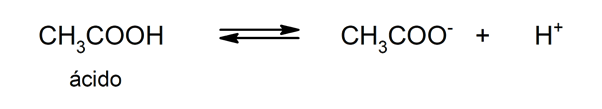
Použití kyselin
Kyseliny mají mnoho použití, v průmyslovém i domácím měřítku. Často se používají jako přísady a konzervační látky v jídlo, kosmetika, nápoje atd. Některé kyselé pevné látky se používají jako katalyzátory (urychlovače chemických reakcí) v petrochemickém nebo papírenském průmyslu.
Existují také kyseliny, které se používají jako dezinfekční prostředky (kyselina karbolová, kyselina salicylová). Kromě toho je lze použít jako elektrolyty v autobateriích, jako je tomu v případě kyseliny sírové. Posledně uvedená silná kyselina se také často používá při zpracování minerály, jako je tomu v případě výroby hnojiv z minerálních fosfátů.
Je třeba objasnit, že určité látky lze solubilizovat pouze v kyselém prostředí a že určité reakce probíhají pouze za takových podmínek. Kyselina dusičná a amoniak činí z dusičnanu amonného také důležité hnojivo pro plodiny.
Příklady kyselin
Níže je uvedeno dvacet kyselin:
- Kyselina chloristá (HClO4). Je to kapalina silné kyseliny a teplota prostředí, vysoce oxidující.
- Kyselina dusičná (HNO3). Je to silná a intenzivně oxidující kyselina, která se používá k výrobě určitých výbušnin a také dusíkatých hnojiv.
- Kyselina askorbová (C6H8NEBO6). Je to vitamin C, tak důležitý pro zdraví. Je to ochranná látka pro své antioxidační účinky.
- Kyselina chlorovodíková (HCl(ac)). Je to jediná silná kyselina, kterou lidské tělo syntetizuje, což je proces, který se specificky vyskytuje v žaludku a provádí degradaci jídlo v zažívacím procesu.
- Kyselina vinná (C4H6NEBO6). Je to bílý krystalický prášek, používá se při přípravě šumivých nápojů, v pekárenském, vinařském a farmaceutickém průmyslu. Krém zubního kamene, který některé recepty nesou, je kyselina vinná.
- Kyselina fluorovodíková (HF(ac)). Díky své schopnosti útočit na sklo se používá při řezbářství a gravírování krystalů.
- Kyselina sírová (H2SW4). Je to silná kyselina par excellence, má nespočet aplikací v různých průmyslová odvětví a syntézních procesů.
- Kyselina trifluoroctová (C2HF3NEBO2). Je to dobré rozpouštědlo pro mnohé organické sloučeniny.
- Kyselina fosforečná (H3PO4). Je přítomen (v nízkých koncentracích) v různých kolových nápojích. Považuje se za zdraví škodlivé, protože podporuje odvápnění.
- Kyselina octová (CH3COOH). Je hlavní složkou octa. Kyselost, kterou vytváří, z něj dělá široce používaný konzervant potravin.
- Kyselina fluoroantimonová (SbHF6). Jedná se o nejsilnější známou superkyselinu, která překonala kyselost čisté kyseliny sírové o 1019.
- Kyselina chromová (H2CrO4). Je to tmavě červený prášek, podílí se na procesu chromování. Používá se také k glazování keramiky.
- Kyselina indoloctová (C10H9NE2). Je hlavním zástupcem auxinů, důležitých pro růstové hormony rostliny.
- Kyselina deoxyribonukleová (DNA). Je to ten, který drží klíč k životu, protože tvoří geny, které řídí syntézu bezpočtu proteinů.
- Trikarboxylové kyseliny. Zahrnují skupinu karboxylových kyselin, které mají tři karboxylové skupiny (-COOH). Kyselina citronová (C6H8NEBO7) Je to jeden z nich.
- Kyselina mravenčí (CH2NEBO2). Je to nejjednodušší z organických kyselin. Dlouhodobé působení této kyseliny může způsobit respirační selhání a smrt.
- Kyselina glukonová (C6H12NEBO7). Soli této kyseliny jsou široce používány při čištění skla.
- Kyselina mléčná (C3H6NEBO3). Je důležitou součástí biochemických procesů.
- Kyselina benzoová (C7H6NEBO2). Je to kyselina s charakteristickým zápachem, která se široce používá k konzervování potravin, které vyžadují a pH kyselina.
- Kyselina jablečná (C.4H6NEBO5). Ve farmaceutickém průmyslu se široce používá k výrobě projímadel.
- Kyselina uhličitá (H2CO3). Na některých místech je součástí procesu formování jeskyní. Je přítomen v sycených nápojích.



