Definice molekulární geometrie
Různé / / January 11, 2022
Pojmové vymezení
Je to struktura molekuly, která určuje trojrozměrné uspořádání atomů, které ji tvoří v prostoru.

Chemický inženýr
Molekulární geometrie jsou v současnosti definovány na základě Teorie of Repulsion of Electronic Pairs of the Valencia Layer (TRPECV). Tato teorie umožňuje předvídat chování chemikálie látek (konkrétně kovalentních) a pomáhá porozumět rozdělení elektroniky, vedoucí k geometrie z molekula. To nám zase umožňuje pochopit mnoho vlastností, které látky získávají.
Tato teorie je založena na řadě základních pilířů, které si projdeme a poté se pokusíme porozumět jejich aplikace praxe. Na prvním místě jsou vázané a nevázané (valenční) elektrony považovány za moře elektronů, které mají stejný typ náboje, vzájemně se odpuzují, takže budou vždy umístěny co nejdále od centrálního atomu molekula.
Za druhé, toto "moře" elektronů nebo "elektronický mrak" tvoří oblasti s vysokou hustotou elektronů, které jsou tvořeny ve vazbách, kde jsou elektrony sdílené nebo v párech elektronů nesdílených. Na druhé straně mohou být vytvořené vazby jednoduché, dvojité nebo dokonce trojité.
Konečně, pro rozhodni se molekulární geometrie, je velmi užitečné mít Lewisovu strukturu, kde se bude počítat množství elektronových hustot kolem centrálního atomu, což dá indikace z názvu její geometrie a tvaru, který molekula trojrozměrně nabývá.
Je třeba poznamenat, že tyto hustoty budou umístěny co nejdále od sebe, aby přijaly co nejstabilnější strukturu a kde je menší odpuzování. Tímto způsobem se nejprve identifikuje elektronová geometrie a poté molekulární geometrie.
Šest úrovní hustoty
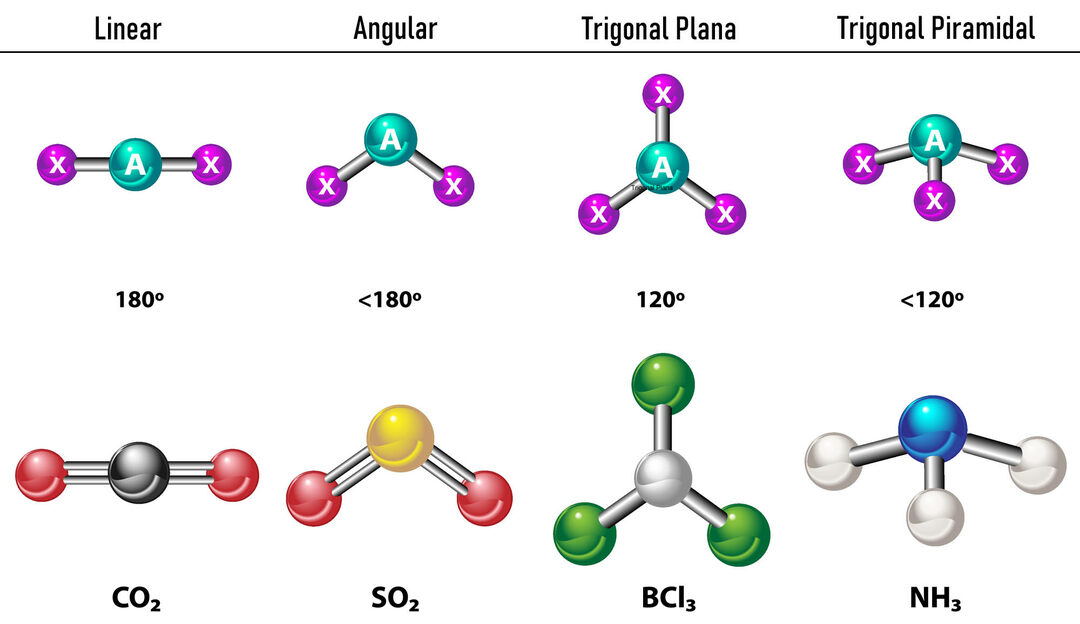
V případě, že jsou kolem centrálního atomu dvě elektronové hustoty, budou vazby umístěny co nejdále od sebe mezi nimi, to znamená 180° od sebe, a proto je jejich elektronová geometrie lineární a molekulárně je také lineární.
V případě, že jsou kolem centrálního atomu tři elektronové hustoty, existují dvě možnosti: tři vazby nebo dvě vazby a jeden nevázaný pár. Pokud existují tři vazby, elektronická geometrie je Trojúhelníkový byt, se 120º úhly mezi vazbami a molekulární geometrií má stejný název. Nyní, pokud existuje nespojený pár, odpuzují se navzájem více intenzita že spojené náboje mají proto tendenci stlačovat vazebné úhly. Úhel mezi volným párem a každou vazbou je 120º a elektronická geometrie je trigonální rovina, zatímco molekulární geometrie je úhlová.
V případě, že kolem centrálního atomu jsou čtyři elektronové hustoty, je elektronová geometrie čtyřstěnná. Pokud jsou všechny čtyři páry elektronů spojeny, jejich molekulární geometrie se svým jménem shoduje s jejich elektronovou geometrií a vazebný úhel je 109,5º. Nyní, pokud je jeden z párů volný, vazebný úhel se zmenší (107º) a molekulární geometrie je typ Trigonální pyramida. Konečně, pokud jsou dva volné páry a dva jsou vázané, úhel vazby je 104,5º, zatímco molekulární geometrie se nazývá Hranatý.
Když je hustota elektronů kolem centrálního atomu pět, nazývá se a Trigonální bipyramida jeho elektronická geometrie. Pokud jsou všechna zatížení spojena, jsou mezi rovníkovými spoji úhly 120°C a mezi axiálními a rovníkovými úhly 90°. Nyní se molekulární geometrie také nazývá trigonální bipyramida, zatímco se čtyřmi spojenými páry a jedním volným párem je molekulární geometrie zkreslená a tvoří dobře známou "rocker“, Tam je jméno, které získává Zkreslený čtyřstěn. Zatímco pokud jsou dva z pěti elektronových párů volné a tři z nich jsou vázané, má geometrii ve tvaru „T“ a jeho jméno je právě kvůli jeho struktuře. Konečně, pokud je to naopak, tři volné páry a dva vázané náboje, molekulární geometrie je lineární.
Nakonec je kolem centrálního atomu šest elektronových hustot a vzniká oktaedr, odtud jeho název v elektronické geometrii. Podobně je pojmenována molekulární geometrie, pokud jsou všechny její páry spojeny. Pokud máte pět spojených párů a jeden volný pár, molekulární geometrie je čtvercová základní pyramida. Pokud máte čtyři vázané páry a dva volné páry, molekulární geometrie je Čtvercový byt.
Obrázek: Sladká příroda
Témata molekulární geometrie
