Pojem v definici ABC
Různé / / April 22, 2022
definice pojmu
Azeotropy jsou směsi chemických sloučenin s definovaným složením, které vrou při určitých teplotách. Základní charakteristikou je, že se směs chová jako jedna čistá látka, zachovává si své vlastnosti a usnadňuje manipulaci.

Chemický inženýr
Směs může být dána dvěma nebo více složkami a jeho složení je to stejné jak v kapalné fázi, tak v plynné fázi, což vytváří podobnosti s čistými látkami. Z toho lze snadno odvodit, že tuto směs nelze rozdělit na její složky procesy jako např frakční destilace, protože, jak již bylo zmíněno výše, si zachová své proporce a chová se, jako by to byla jediná součástka.
Další charakteristikou je, že bod varu této směsi může být vyšší, nižší nebo dokonce stejný jako bod varu jedné z jejích složek. Když se azeotrop vaří při a teplota maximálního varu, je známý jako maximální azeotrop, a když tak činí při nejnižší možné teplotě, je známý jako minimální azeotrop. To znamená, že minimální azeotrop má nižší bod varu než jeho čisté složky a naopak s maximálním azeotropem. Například ve směsi metanol - benzen je azeotrop minimální (0,61 benzenu - 0,39 methanolu ve frakcích molární), jehož bod varu je 58 °C, v nádrži, kde bod varu benzenu je 80 °C a methanolu 65 °C
Minimální a maximální azeotropy
Nyní... odkud pochází azeotrop? Když dojde k odchylce od Zákon Raoult, to znamená, že tlak par azeotropní směsi přímo nesouvisí s jejím molárním zlomkem, právě tehdy vzniká pojem azeotropní směs. K těmto odchylkám dochází, když se složky výrazně přitahují nebo odpuzují, to znamená, že mezimolekulární síly jsou v různých sloučeninách velmi odlišné.
Když je odchylka kladná, máme minimální azeotrop, zatímco pokud je odchylka záporná, máme maximální azeotrop. Pro lepší pochopení tohoto konceptu se podívejme na některé grafiky:
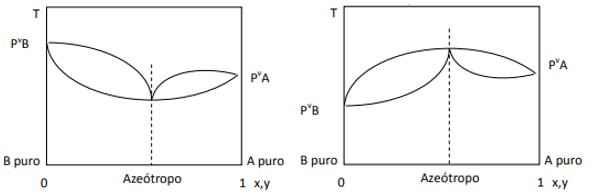
Zde pozorujeme, že pokud by směs byla ideální, podle Raoultova zákona by tlaky par čistých složek měly být spojeny přímkou, protože no, existuje odchylka od tohoto zákona, která způsobuje tvorbu minimálních a maximálních azeotropů, v závislosti na tom, zda mezi nimi existuje větší nebo menší afinita. komponenty. Když je odchylka od Raoultova zákona záporná, jako na obrázku vlevo, je minimální at diagram tlaku, ale maximum v teplotním diagramu (tudíž azeotrop maxima). Na druhou stranu, pokud je odchylka kladná na Raoultův zákon, bude to maximum v tlaku vs. složení, ale minimum v diagramu teplota vs. složení (zde máme minimální azeotrop). Nepleťte si diagramy tlak vs. složení a teplota vs. složení.
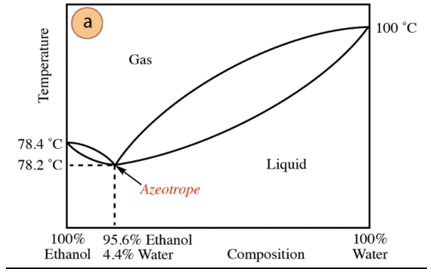
V případě směsi ethanol-voda existuje minimální azeotrop, jehož složení je 95,6 % ethanolu a 4,4 % vody. Teplota varu azeotropní směsi je o 78,2 °C nižší než u čistých složek. Předpokládejme tedy, že destilujete směs vody a ethanolu s vysokým obsahem vody (téměř 100 %). Nebude možné získat čistý alkohol, protože v každém destilačním stupni budou získány větší frakce. etanolu, ale nikdy nedosáhne 100 %, postupně se bude blížit složení azeotropní směsi (nejnižší bod pod). Proto má, stejně jako voda, tendenci tvořit minimální azeotropy organické sloučeniny (vzhledem k typu intermolekulárních sil, které interagují), je nutné předem odstranit vodu ze směsi, aby se získala čistá sloučenina. Nebo, jakmile je získán azeotrop, způsoby těžba další vody.
Na základě výše uvedeného není náhodou najít alkohol (v supermarketu a LÉKÁRNA) na 95 %, je nejlevnějším produktem, který lze získat. Pro získání čistého alkoholu je nutné azeotrop „rozbít“. technika další, jako je použití sušících činidel nebo azeotropních destilací. Azeotropní destilace spočívá v přidání další složky do směsi, která působí strháváním a působením interakce s některou ze složek směsi (vyšší afinitou) lze ze směsi odstranit.
Témata v azeotropech

