50 Příklady aldehydů a ketonů
Příklady / / November 06, 2023
The aldehydy jsou organické sloučeniny které mají ve své struktuře karbonylovou funkční skupinu (= C = O), která je navázána na uhlíkový řetězec a atom vodíku. Například: methanal (také nazývaný formaldehyd), ethanal (také nazývaný acetaldehyd) a propanal (také nazývaný propaldehyd).
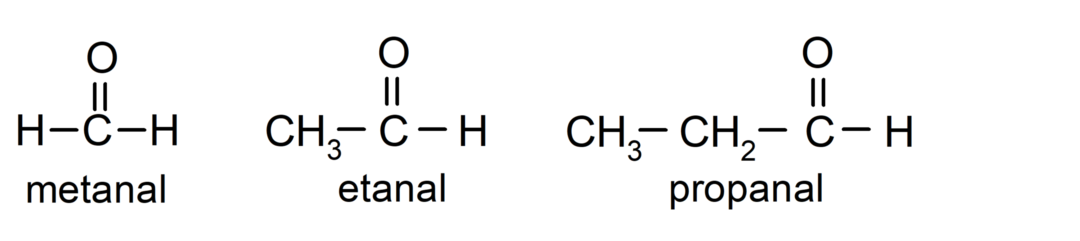
The ketony Jsou to organické sloučeniny, které mají ve své struktuře karbonylovou skupinu vázanou na dva atomy uhlíku. Například: propanon (také nazývaný aceton), butanon a 2-pentanon.
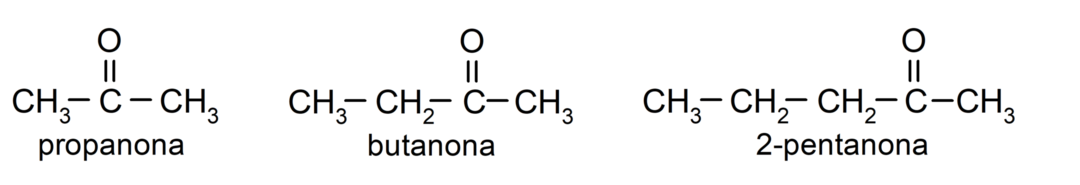
Rozdíly mezi aldehydy a ketony
Hlavní rozdíly mezi aldehydy a ketony jsou:
- Aldehydy mají ve své struktuře karbonylovou funkční skupinu umístěnou na jednom terminálním konci, zatímco ketony mají karbonylovou skupinu umístěnou v nekoncových polohách svých struktura.
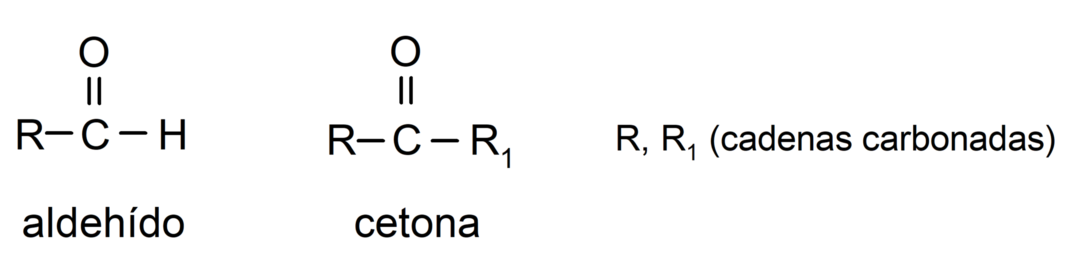
- Aldehydy se oxidují reakcí s Tollensovým činidlem za vzniku kovového stříbra. Také oxidují proti Benediktovu činidlu a tvoří oxid měďný. Ketony nejsou oxidovány ani jedním činidlem.
- Aldehydy se redukují na primární alkoholy, zatímco ketony se redukují na sekundární alkoholy.
Fyzikální vlastnosti
Fyzikální vlastnosti aldehydů
Fyzikální vlastnosti aldehydů jsou velmi rozmanité, protože závisí na konstituci uhlíkového řetězce, který je spojen s karbonylovou skupinou.
Někteří jsou:
- Aldehydy, které jsou nejvíce rozpustné ve vodě, jsou ty, které jsou menší velikosti, jako je metan a ethanal.
- Těkavé aldehydy mají štiplavý a dokonce dráždivý zápach.
- Karbonylová skupina jim dává polaritu.
- Obvykle mají vyšší body varu než chemické sloučeniny podobné molekulové velikosti.
Fyzikální vlastnosti ketonů
Fyzikální vlastnosti ketonů závisí na tom, jak se tvoří uhlíkový řetězec, který je spojen s karbonylovou skupinou.
- Mnoho ketonů má příjemnou vůni.
- Jeho rozpustnost ve vodě závisí na velikosti uhlíkového řetězce připojeného ke karbonylové skupině. Čím menší uhlíkový řetězec, tím rozpustnější bude keton ve vodě.
- Karbonylová skupina jim dává výraznou polaritu.
- Mají poměrně vysoké body varu ve srovnání s chemickými sloučeninami srovnatelné velikosti molekul.
Chemické vlastnosti
Chemické vlastnosti aldehydů
Mezi chemickými vlastnostmi aldehydů můžeme najít:
Jsou oxidovány za vzniku odpovídající karboxylové kyselinyto znamená, že vytvořená kyselina bude mít stejný počet uhlíků v uhlíkovém řetězci jako aldehyd to dalo vzniknout. Například:
- Oxidace Tollensovým činidlem (amoniakový komplex stříbra v zásaditém roztoku, [Ag (NH3)2]+) z ethanalu vyrábí kyselinu ethanovou a kovové stříbro.
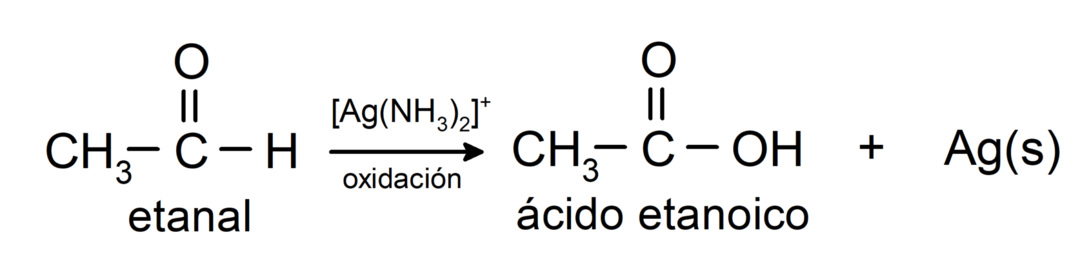
- Oxidací Benediktovým činidlem (alkalický roztok síranu měďnatého) ethanalu vzniká kyselina ethanová a oxid měďný.
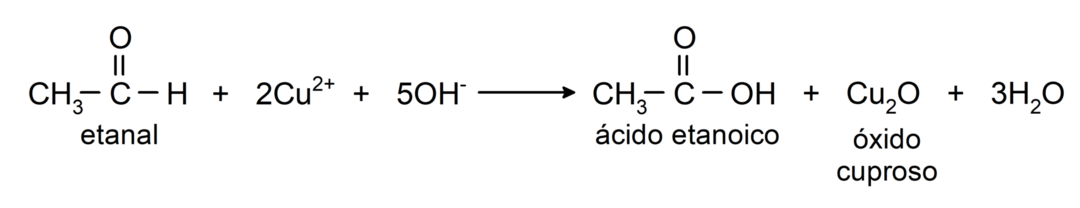
Podléhají nukleofilním adičním reakcímto je adice nukleofilu ke karbonylové skupině. Například:
- Přidání kyseliny kyanovodíkové za vzniku kyanohydrinů nebo kyanohydrinů.
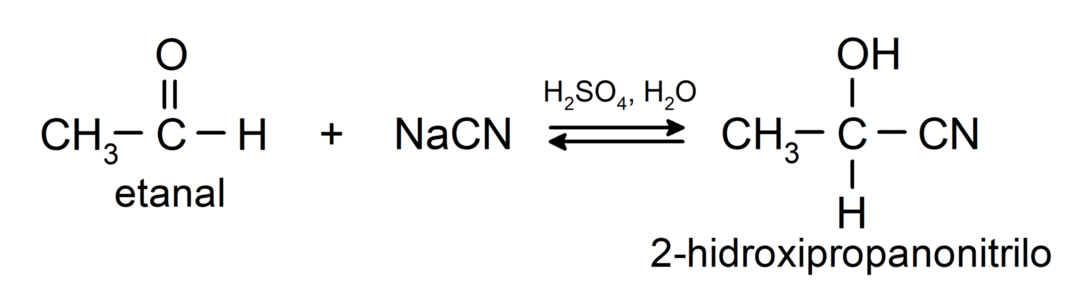
- V přítomnosti bezvodých kyselin se ke karbonylové skupině aldehydů přidávají alkoholy za vzniku acetalů a poloacetalů.
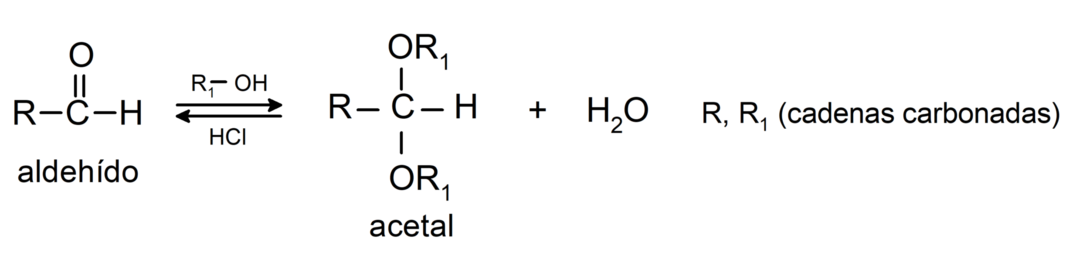
Podléhají aldolovým kondenzačním reakcím. Při těchto reakcích dochází ke spojení dvou aldehydů v přítomnosti hydroxidu sodného (NaOH) a chemická sloučenina výsledný se nazývá aldol. Například:
- Kondenzační reakce ethanalu v přítomnosti zředěného NaOH.
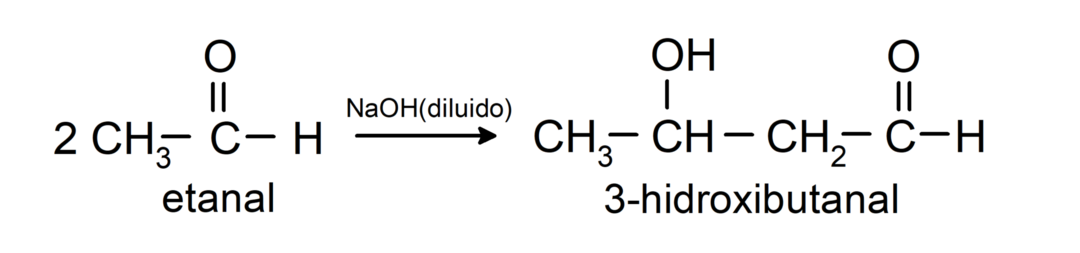
Jsou redukovány na primární alkoholy. Aldehydy lze redukovat na primární alkoholy katalytickou hydrogenací nebo redukcí borohydridem sodným (NaBH).4) a lithiumaluminiumhydrid (LiAlH4).
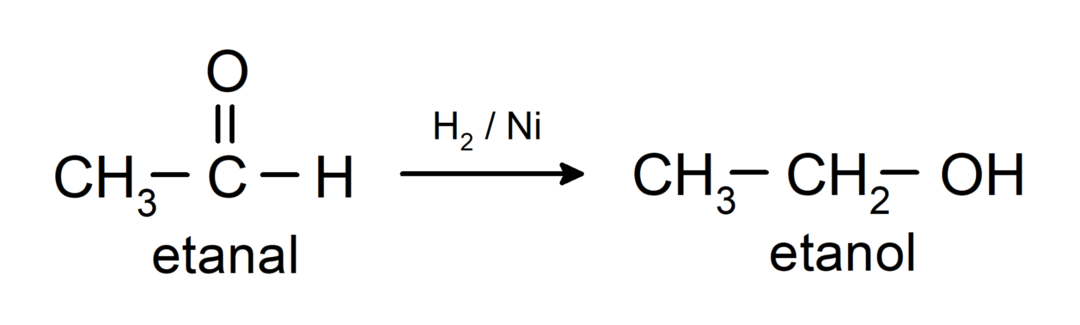
Chemické vlastnosti ketonů
Mezi chemické vlastnosti ketonů můžeme najít:
Podléhají nukleofilním adičním reakcím. Například:
- Přidání kyseliny kyanovodíkové za vzniku kyanohydrinů nebo kyanohydrinů.
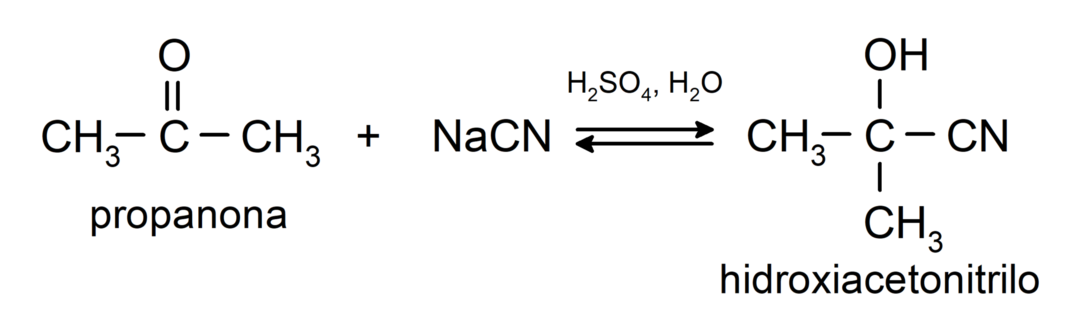
Přidávají alkohol (v přítomnosti bezvodých kyselin) na karbonylovou skupinu ketonů za vzniku ketalů a hemiketalů. Například:
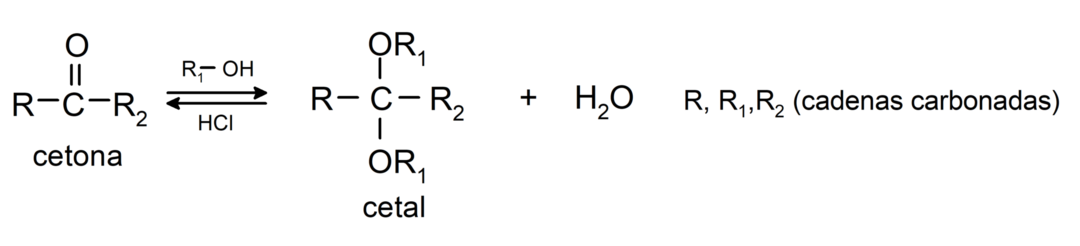
Podléhají halogenačním reakcím. Ketony, které mají alfa vodík (α) reagovat nahrazením tohoto vodíku halogeny (chlor (Cl), brom (Br), jod (I), fluor (F)) v přítomnosti kyselých nebo bazických katalyzátorů. K substituci dochází téměř výhradně v uhlíku α, tedy uhlík, který se navázal na vodík α. Například:
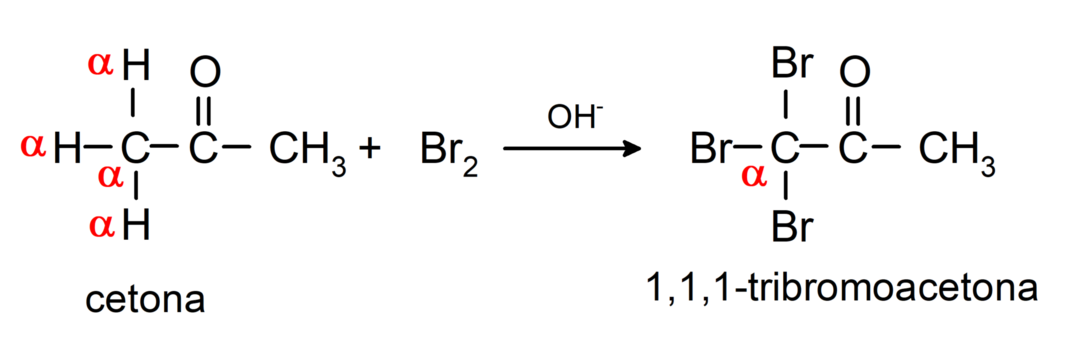
Jsou redukovány na sekundární alkoholy katalytickou hydrogenací nebo redukcí borohydridem sodným (NaBH4) a lithiumaluminiumhydrid (LiAlH4). Například:
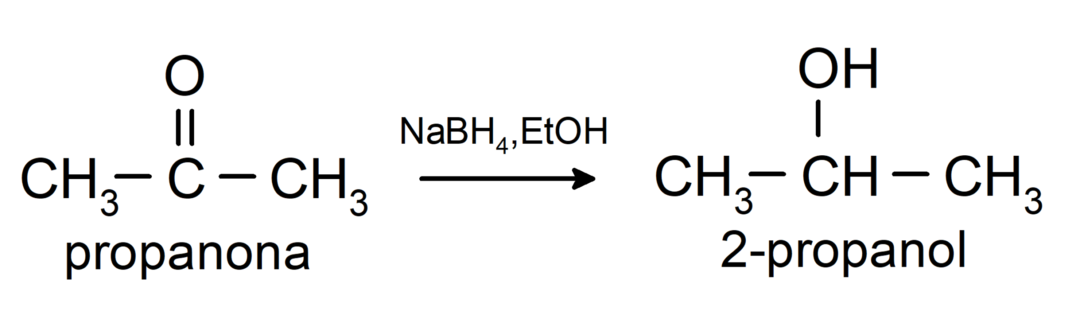
Ketony nejsou oxidovány Tollensovými a Benedictovými činidly.
Názvosloví aldehydů
Podle pravidel stanovených Mezinárodní unií čisté a aplikované chemie (IUPAC) Aldehydy jsou pojmenovány pomocí předpon, které označují počet uhlíků v řetězci. sycené oxidem uhličitým. Není nutné specifikovat polohu karbonylové skupiny, protože je vždy v poloze jedna na jednom konci molekuly. Navíc se na konci názvu aldehydu píše přípona -al. Například:
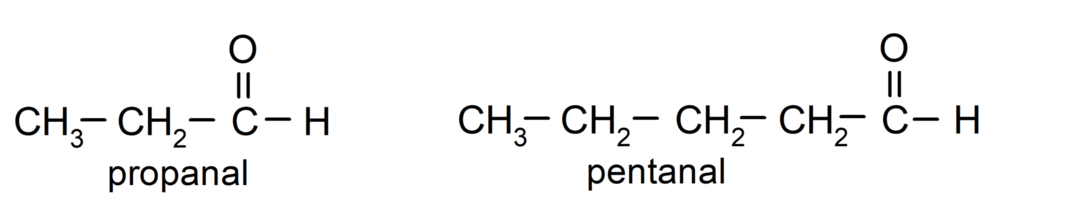
Pokud je aldehyd tvořen několika uhlíkovými řetězci, to znamená, že má větvení, zvolí se jako hlavní řetězec uhlíkový řetězec s největším počtem atomů uhlíku. Ostatní řetězce jsou pojmenovány jako substituční skupiny a poloha každého substituentu je zvolena tak, aby zabíral co nejmenší počet v řetězci. Kromě toho se atomy uhlíku začnou počítat od konce, který má karbonylovou skupinu. Například:
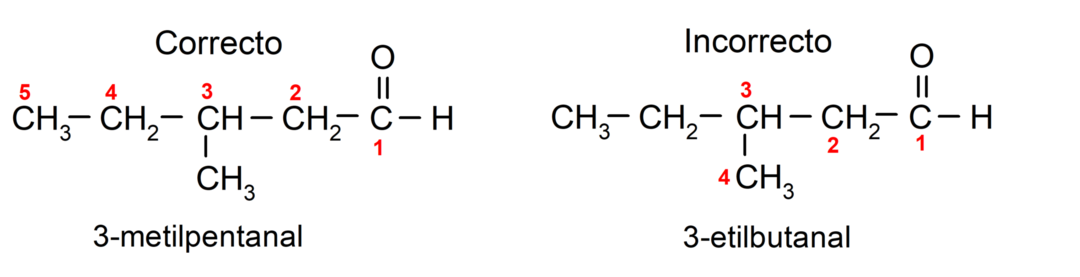
Aldehydy, které mají dvě karbonylové skupiny, jsou pojmenovány pomocí přípony -dial. Například:
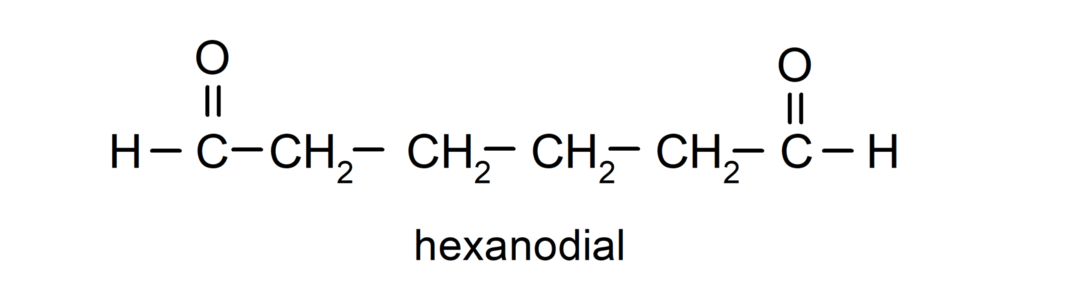
Ketonová nomenklatura
Podle International Union of Pure and Applied Chemistry (IUPAC) jsou ketony pojmenovány pomocí předpon, které označují počet uhlíků v uhlíkovém řetězci.
Na druhou stranu se název acetonu píše pomocí přípony -one, před kterou je uvedeno číslo, které označuje polohu karbonylové skupiny v uhlíkovém řetězci. Umístění karbonylové skupiny by mělo být zvoleno tak, aby odpovídalo nejnižšímu možnému číslování. Například:
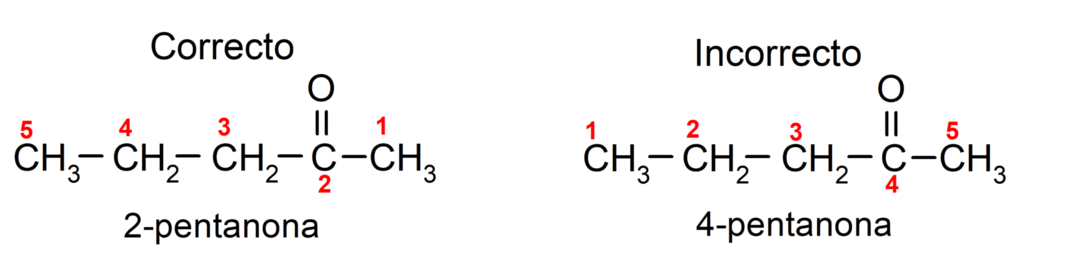
Pro pojmenování ketonu, který se skládá z několika uhlíkových řetězců, tedy s větvemi, volíme jako hlavní řetězec uhlíkový řetězec s největším počtem atomů uhlíku, který obsahuje skupinu karbonyl. Zbývající řetězce jsou pojmenovány jako substituční skupiny. Například:
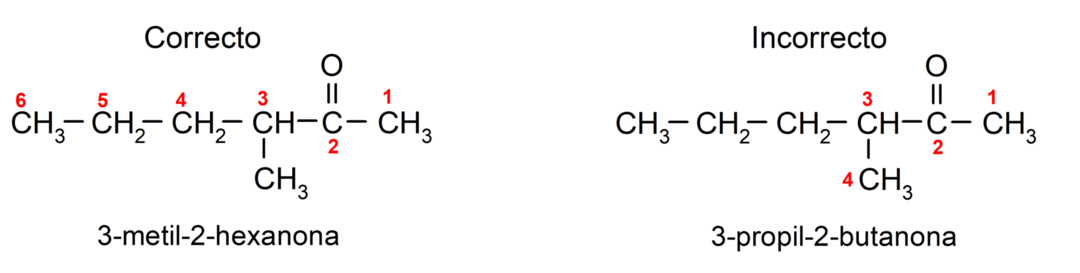
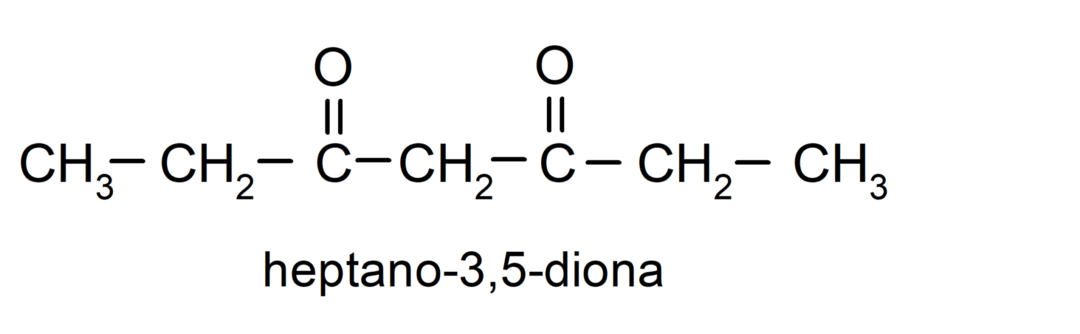
Existují ketony, které mají dvě karbonylové skupiny, nazývají se diony. Například:
Příklady aldehydů
- metan (formaldehyd)
- ethanal (acetaldehyd)
- propanal (propaldehyd)
- butanal
- pentanal
- hexanal
- 3-bromcyklopentankarbaldehyd
- cyklohexankarbaldehyd
- benzaldehyd
- 4,4-dimethylpentanal
- 2-hydroxybutanal
- 2-hydroxy-2-methylbutanal
- 2,3-dimethylpentanal
- pentanedial
- 4-hydroxy-3-methoxybenzaldehyd
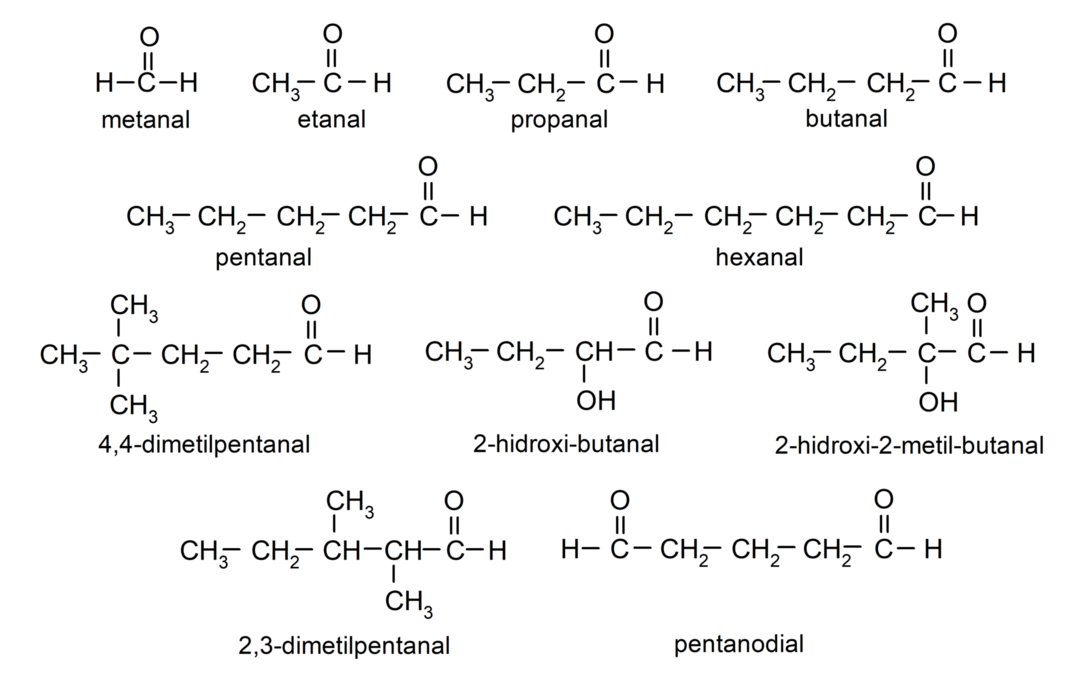
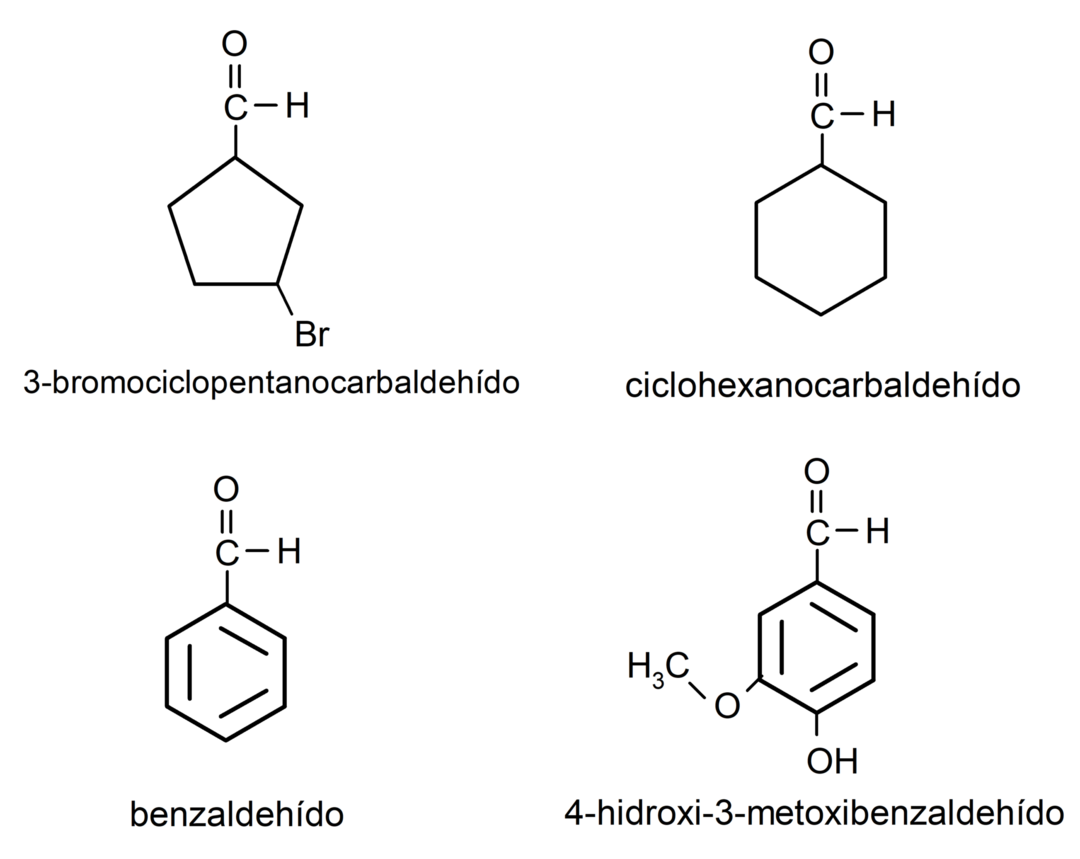
Příklady ketonů
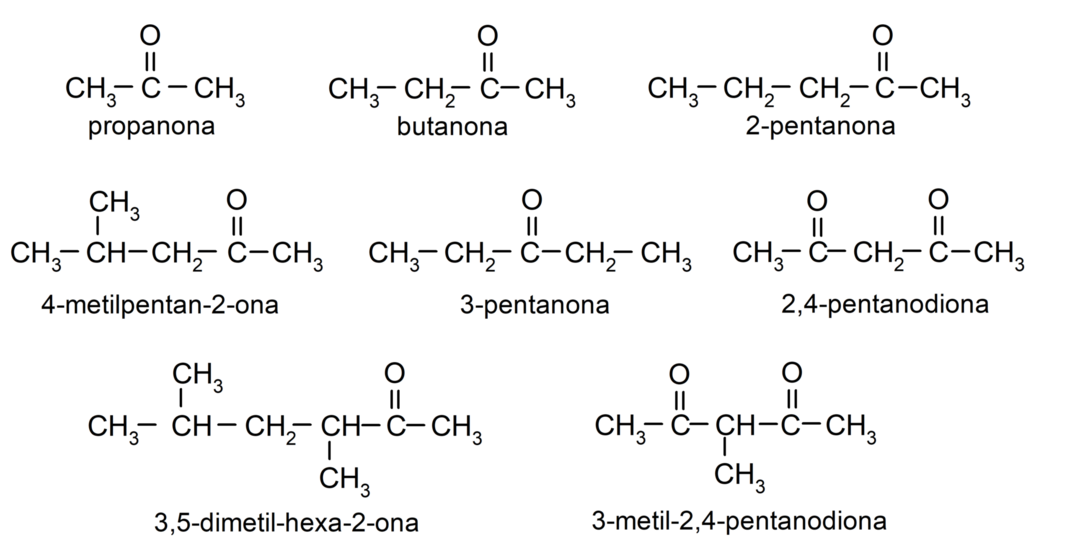
- propanon (aceton)
- butanon
- 2-pentanon
- 4-methylpentan-2-on
- 3-methylcyklohexanon
- cyklohexylmethylketon
- 3,4-dimethylhexan-2-on
- ethylfenylketon
- 2,4-pentandion
- cyklohexanon
- 3-pentanon
- 3-methyl-2,4-pentandion
- 1-fenylpropanon
- cyklopentanon
- difenylketon
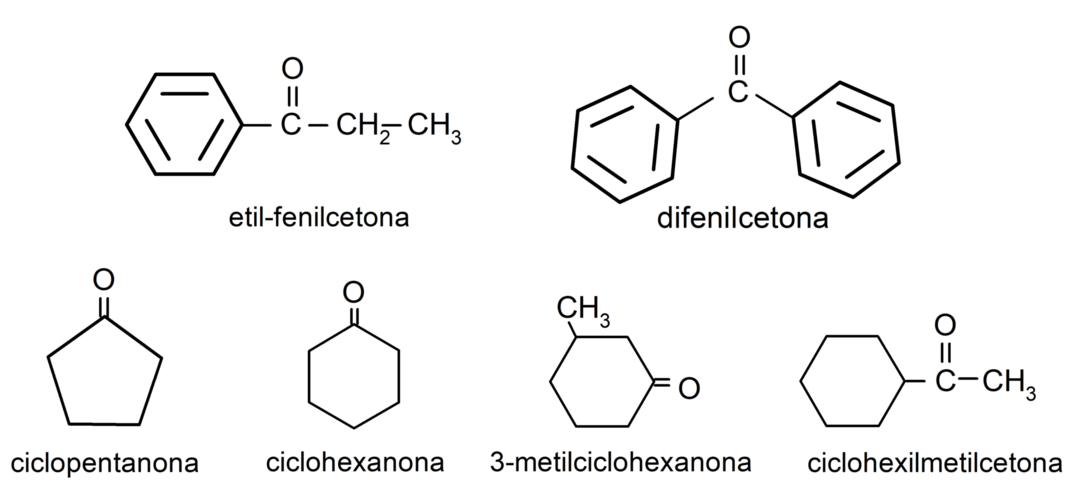
Využití aldehydů v každodenním životě
Některá použití aldehydů jsou:
- Používají se k výrobě rozpouštědel, barev, parfémů, pryskyřic a esencí.
- Používají se jako konzervační látky v kosmetických přípravcích, biologických vzorcích a mrtvolách. K těmto účelům se nejvíce používá formaldehyd.
- Vyrábějí se z nich plasty, které umožňují výměnu kovových dílů v automobilovém průmyslu.
- Používají se jako dochucovadla některých potravin.
- Používají se jako dezinfekční prostředky.
- Používaly se k výrobě některých výbušnin, jako je pentaerythritoltetranitrát (TNPE).
Využití ketonů v každodenním životě
Některá použití ketonů jsou:
- Používají se při výrobě rozpouštědel. Zejména aceton je široce používán k odstraňování barev a laků.
- Používají se při výrobě některých pryží a maziv.
- Používají se k výrobě barev, laků a laků.
- Používají se k výrobě léků a kosmetiky.
Aldehydová a ketonová toxicita
- Aldehydy. Kontakt s aldehydy způsobuje podráždění kůže, očí a dýchacích cest. Kromě toho je expozice aldehydům spojována s nemocemi, jako je rakovina, kontaktní dermatitida a jaterní a neurodegenerativní onemocnění. Za karcinogenní sloučeninu WHO (Světová zdravotnická organizace) považuje například formaldehyd.
- ketony. Opakovaná expozice ketonům může způsobit poškození centrálního nervového systému. To může vést ke ztrátě paměti, slabosti, bolestem svalů a křečím. Navíc, pokud se pokožka dostane do kontaktu s ketony, dochází k vysušení a prasklinám. Na druhou stranu při vdechování ketonů dochází k podráždění dýchacích cest a kašli.
Reference
- Llorens Molina, JA. (2018). “Aldehydy a ketony: Některé příklady.” http://hdl.handle.net/
- Gabriel Pinto Cañón, Manuela Martín Sánchez, José María Hernández Hernández, María Teresa Martín Sánchez (2015) “Tollensovo činidlo: od identifikace aldehydů k jejich použití v nanotechnologii. Historické aspekty a didaktické aplikace."Sv. 111 č. 3. Královská španělská společnost chemie.
- William Bauer, Jr. (2000) «Kyselina metakrylová a její deriváty» v Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. DOI: 10.1002/14356007.a16_441.
- „Odhalují nový mechanismus toxicity ve skupině karcinogenních sloučenin pocházejících ze stravy a životního prostředí“ (2022) In: www.conicet.gov.ar K dispozici v: https://www.conicet.gov.ar/ Přístup: 20. června 2023.
Postupujte s:
- Alkoholy
- Cukry
- Alkany



