30 Příklady alkoholů
Příklady / / November 06, 2023
The alkoholy jsou organické chemické sloučeniny které ve své struktuře obsahují hydroxylovou funkční skupinu (-OH) připojenou k uhlíku (-C). Skupina (- C – OH) se nazývá „karbinol“. Některé příklady alkoholů jsou: methanol, ethanol a 1-propanol.
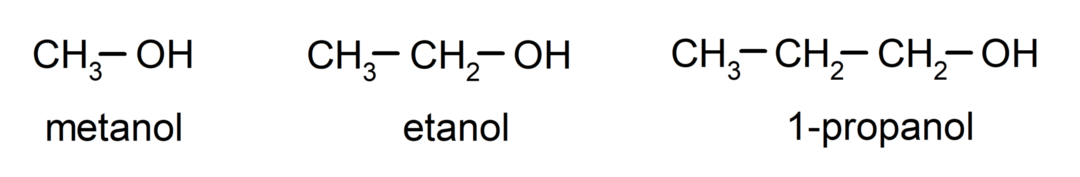
Alkoholy jsou chemické sloučeniny s různým využitím v každodenním životě, protože mají antibakteriální a antiseptické vlastnosti. Na druhou stranu mohou být při nekontrolovaném požití nebezpečné pro lidské zdraví.
Stejně tak ne všechny alkoholy mohou lidé požívat.
- Viz také: Aminy a ketony
Druhy alkoholů
V závislosti na počtu atomů uhlíku, ke kterým je připojen atom uhlíku, který má připojenou hydroxylovou skupinu, může být alkohol:
- Primární alkohol. Atom uhlíku, ke kterému je připojena hydroxylová skupina, je také připojen k jedinému atomu uhlíku. Například:
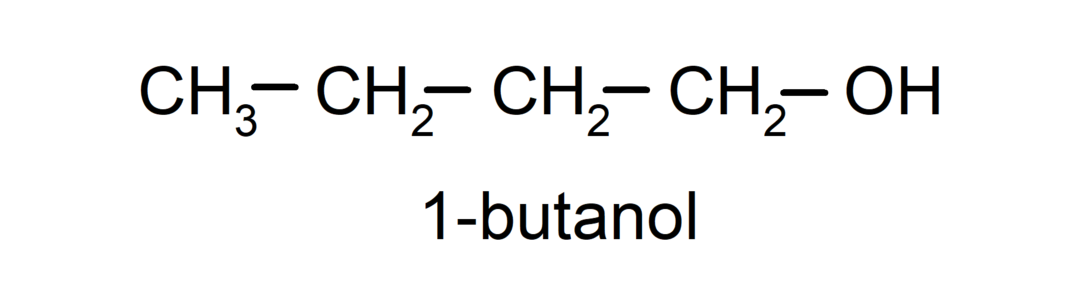
- Sekundární alkohol. Atom uhlíku, ke kterému je připojena hydroxylová skupina, je také vázán ke dvěma dalším atomům uhlíku. Například:
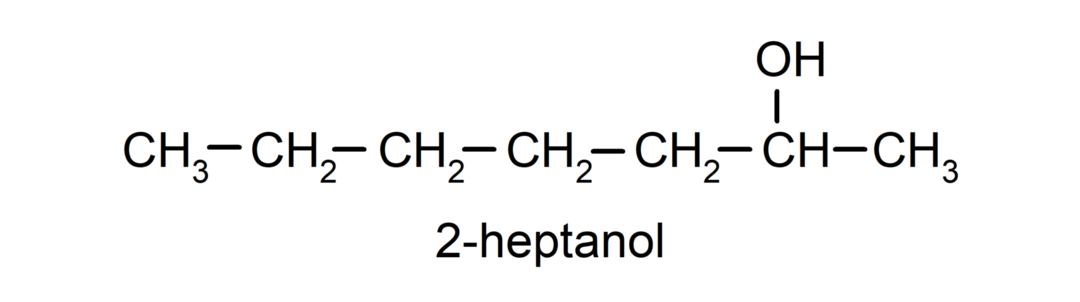
- Terciární alkohol. Atom uhlíku, ke kterému je připojena hydroxylová skupina, je také připojen ke třem atomům uhlíku. Například:
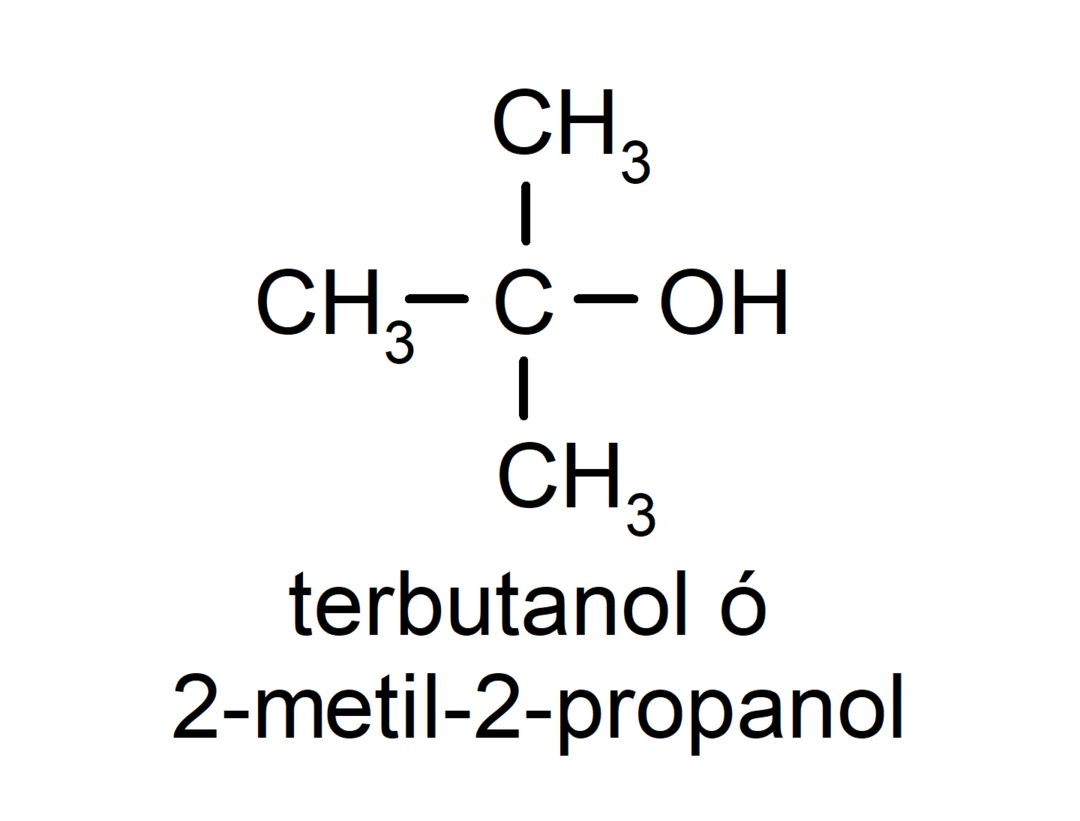
V závislosti na počtu hydroxylových skupin, které má, může být alkohol:
- Diol. Ve své struktuře má dvě hydroxylové skupiny. Například:
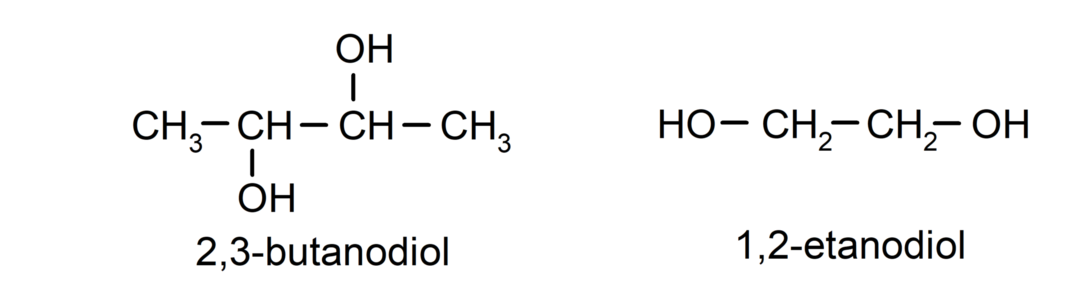
- Triol. Ve své struktuře má tři hydroxylové skupiny. Například:
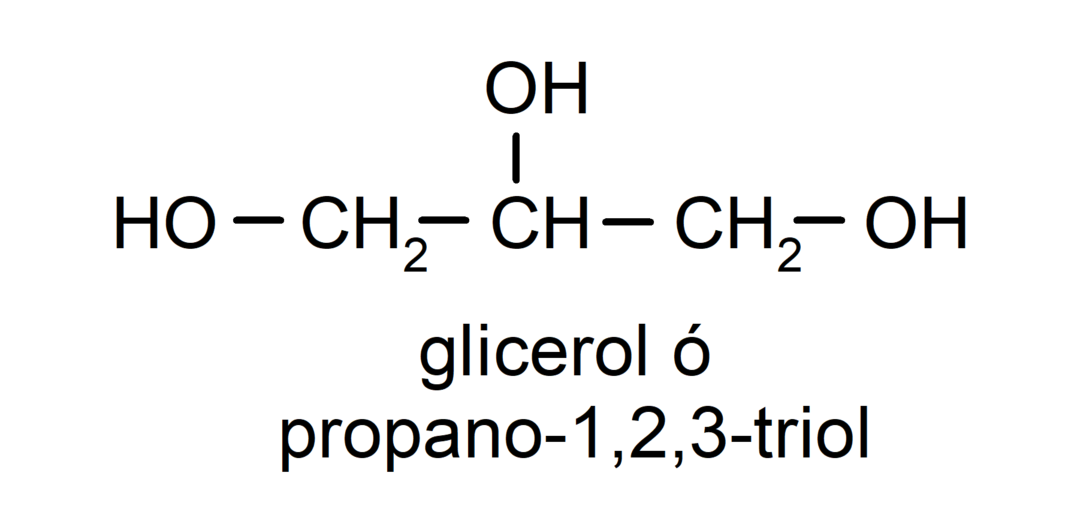
- Polyalkohol. Ve své struktuře má mnoho hydroxylových skupin. Například:
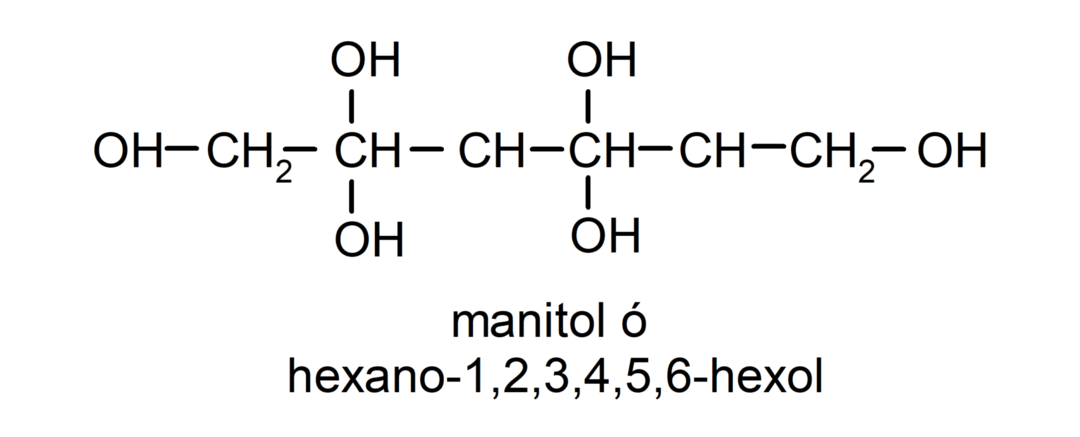
Fyzikální vlastnosti alkoholů
Některé z fyzikálních vlastností alkoholů jsou:
- Bod varu. Bod varu v alkoholech je poměrně vysoký díky přítomnosti hydroxylové skupiny, která umožňuje tvorbu vodíkových vazeb. Dále, čím více hydroxylových funkčních skupin je přítomno v uhlíkovém řetězci, tím vyšší je Bod varu alkoholů.
- Polarita. Alkoholy jsou docela polární sloučeniny.
- Rozpustnost. Nízkomolekulární alkoholy jsou rozpustné ve vodě. Na druhou stranu, čím větší uhlíkový řetězec alkoholů, tím nižší je jejich rozpustnost ve vodě. Navíc, čím více hydroxylových skupin mají alkoholy, tím větší je jejich rozpustnost ve vodě.
- Skupenství. Většina alkoholů je při pokojové teplotě (25ºC) kapalná a má charakteristický zápach.
Chemické vlastnosti alkoholů
Některé z chemických vlastností alkoholů jsou:
- Alkoholy se chovají jako kyseliny a zásady.. Jejich chování jako kyselin lze pozorovat při reakcích s aktivními kovy za uvolňování plynného vodíku a vytváření alkoxidů.

Jejich chování jako báze lze pozorovat při reakcích, jako je reakce methanolu s bromovodíkem za vzniku methyloxoniumbromidu.
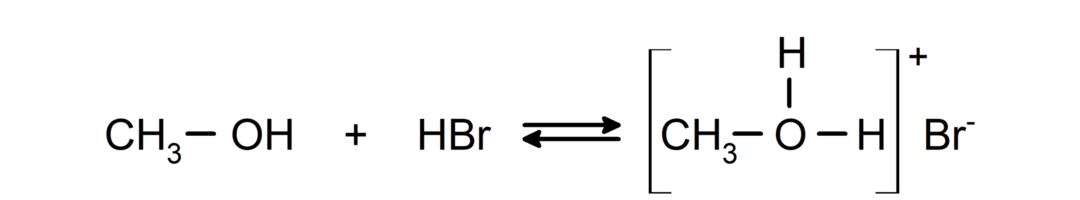
- Alkoholy podléhají halogenačním reakcím. Reagují s halogenovodíky za vzniku alkylhalogenidů.
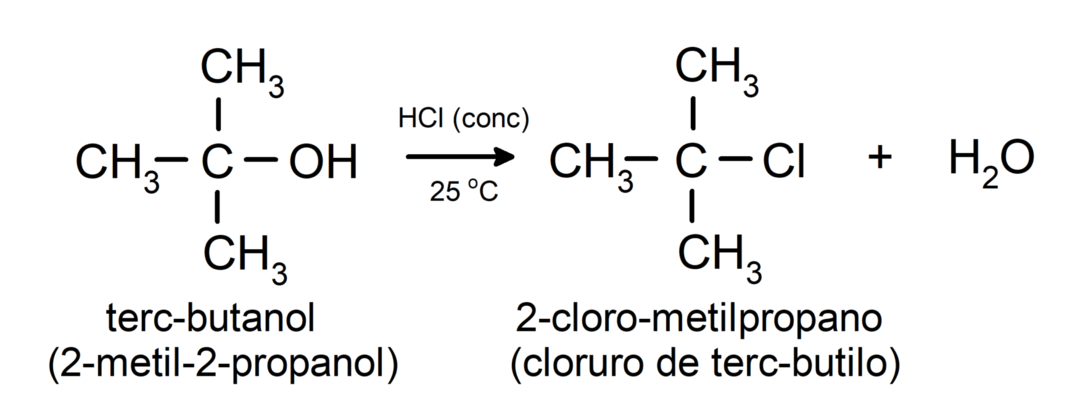
-
Alkoholy podléhají oxidačním reakcím když reagují s určitými oxidačními sloučeninami. Produkty oxidačních reakcí závisí na typu reagujícího alkoholu, tedy zda je primární, sekundární nebo terciární.
Oxidace primárního alkoholu za vzniku aldehydu nebo karboxylové kyseliny.
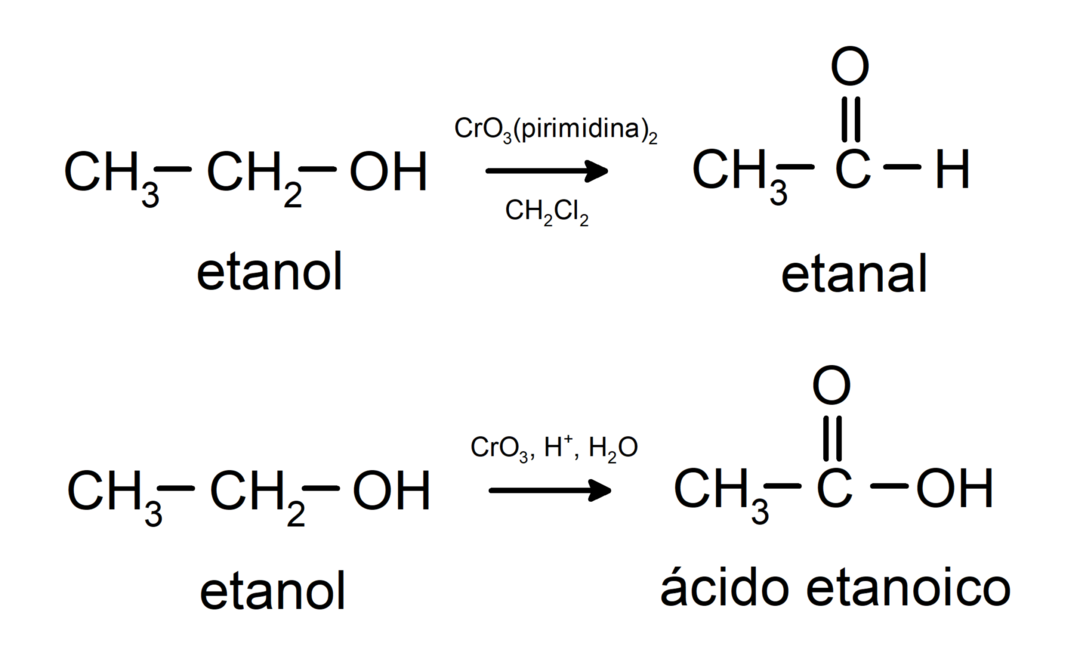
Oxidace sekundárního alkoholu za vzniku ketonu.
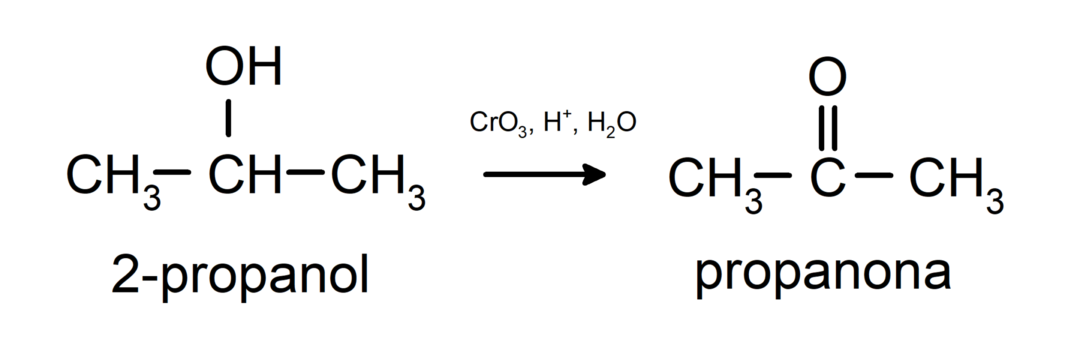
Terciární alkoholy neoxidují běžnými oxidanty. Pomocí velmi silných oxidačních činidel mohou být přeměněny na alkeny, které pak mohou být oxidovány.
Alkoholy, které mají dvě hydroxylové skupiny umístěné na sousedních uhlíkech, se oxidují octanem olovnatým za vzniku dvou ketonů.
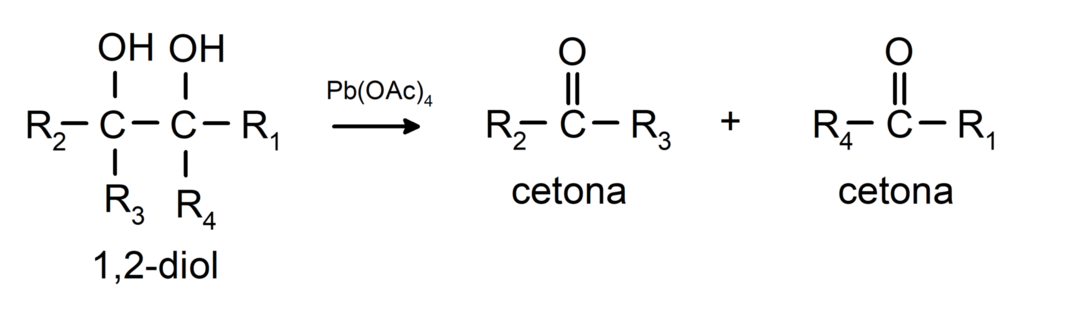
- Alkoholy podléhají dehydrogenačním reakcím. Tyto reakce probíhají pouze s primárními a sekundárními alkoholy, které při vystavení vysokým teplotám v přítomnosti katalyzátorů uvolňují vodíky.
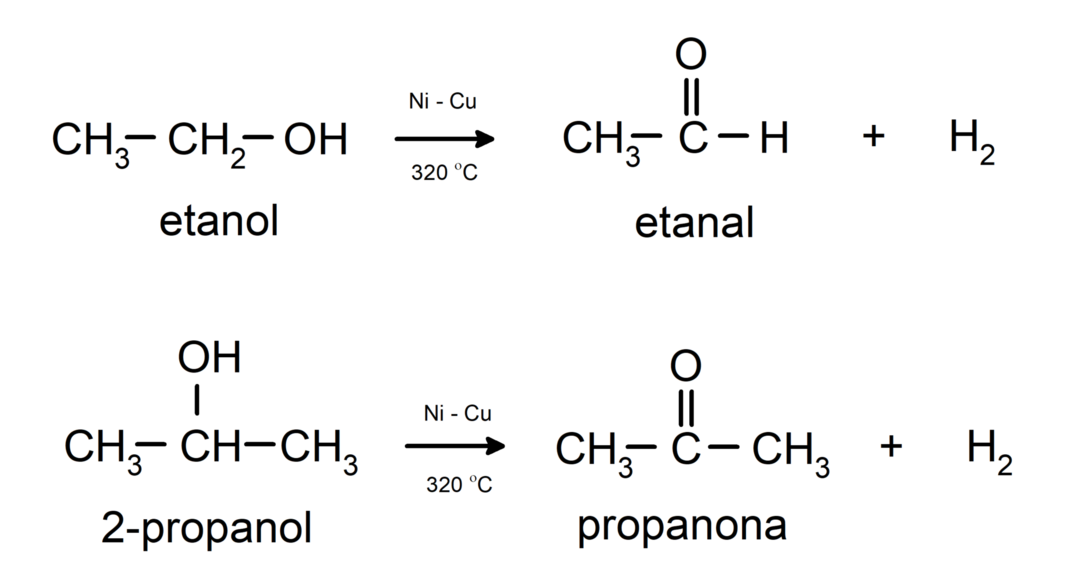
- Alkoholy podléhají dehydratačním reakcím. Alkoholy se dehydratují za vzniku odpovídajících alkenů. K této reakci dochází v přítomnosti kyselin a středních teplot.
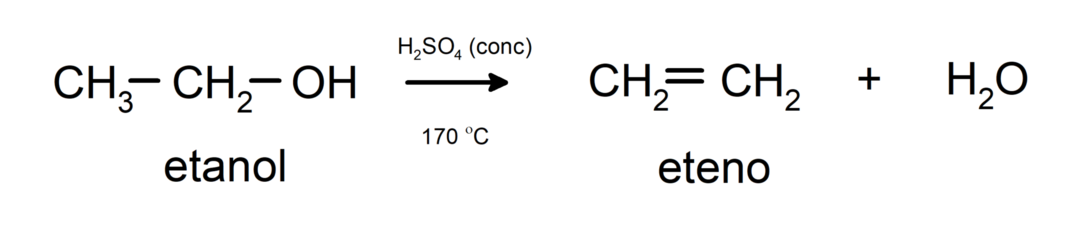
Názvosloví alkoholu
Podle nomenklatury stanovené IUPAC (International Union of Pure and Applied Chemistry) jsou alkoholy pojmenovány podle následujících pravidel:
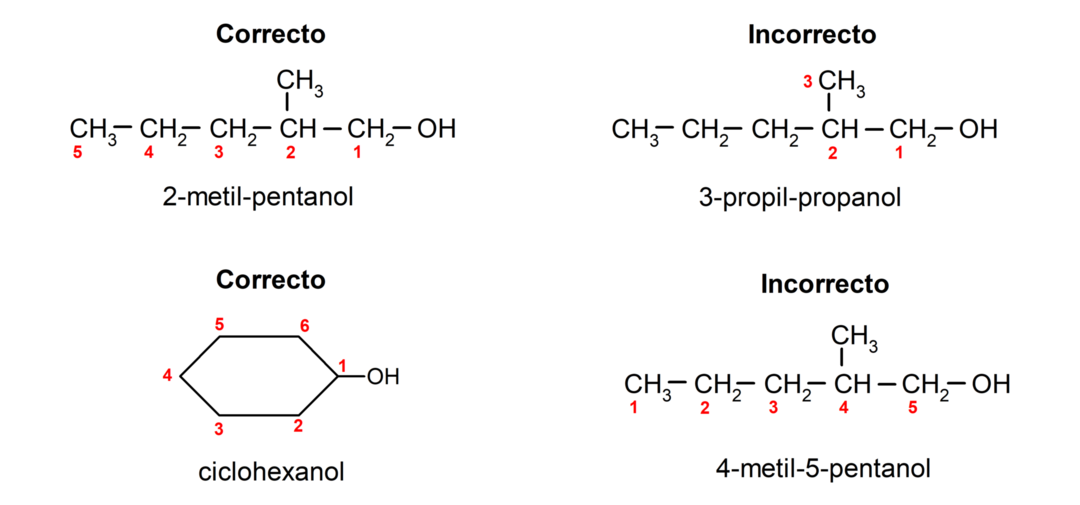
- Poloha hydroxylové skupiny se volí s ohledem na to, že zaujímá nejnižší možné číslo v uhlíkovém řetězci. Pokud je struktura alkoholu cyklická, uvažuje se poloha 1 na uhlíku, ke kterému je připojena hydroxylová skupina, a k jejímu pojmenování se používá předpona cyclo-.
- Název alkoholu se píše pomocí předpon, které označují počet atomů v uhlíkovém řetězci, a navíc se umísťuje přípona -ol.
- Má-li struktura alkoholu větve, je jako hlavní uhlíkový řetězec zvolen nejdelší řetězec, který obsahuje také hydroxylovou skupinu.
Podle tradiční nomenklatury se alkoholy pojmenovávají tak, že se napíše slovo „alkohol“ a poté se napíše název alkoholu. alkan odpovídající uhlíkovému řetězci, ale místo použití koncovky -ane alkanu, koncovka -ylický.
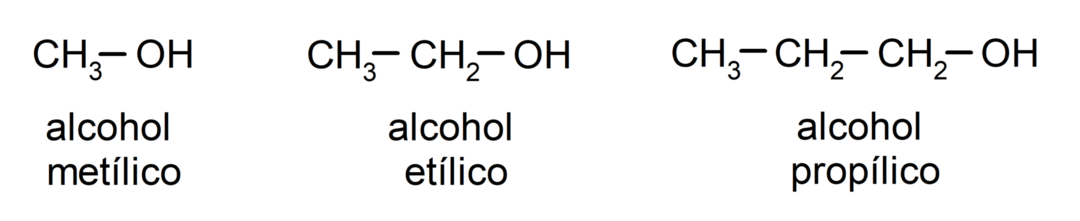
Příklady alkoholů
- methanol
- ethanol
- 1-propanol
- 2-propanol
- 1-butanol
- 3-ethylhexan-2-ol
- glycerol
- fenol
- 2-methyl-2-butanol
- 1,2-ethandiol
- 1,5-heptadien-3-ol
- 3-methyl-2-butanol
- benzylmethanol
- 3-pentanol
- 2-methylfenol
- 1,2-dihydroxyfenol
- cykloheaxnol
- 1-fenylethanol


Použití alkoholů
Nejběžnější použití alkoholů jsou:
- Používají se jako dezinfekční prostředky a antiseptika, protože u některých zastavují růst mikroorganismy nebo je zničit. K tomuto účelu se nejvíce používá ethanol a isopropylalkohol.
- Používají se při syntéze různých chemické sloučeniny. Methanol se například používá k získávání metanu (formaldehydu).
- Používají se k výrobě nemrznoucí směsi. Metanol je pro tento účel jedním z nejpoužívanějších.
- Používají se jako rozpouštědla ve farmaceutickém průmyslu. Ethanol je v tomto smyslu jedním z nejpoužívanějších.
- Používají se jako rozpouštědla pro laky, barviva a inkousty. K tomuto účelu se široce používá metanol.
- Používají se jako palivo a je zde důležitá tendence jejich použití částečně nahrazovat fosilní paliva pomocí bioetanolového paliva.
- Používají se k výrobě pryskyřic. V tomto smyslu se používá fenol.
Nebezpečí konzumace alkoholu
Přestože je dnes konzumace alkoholu společensky akceptována, zneužívání této látky vytváří závislost a závislost.
Ethanol je alkohol přítomný v alkoholických nápojích, který při nadměrné konzumaci ovlivňuje kognitivní schopnosti a může způsobit kardiovaskulární onemocnění, cirhózu jater a rakovina.
Dále při dosažení stupně intoxikace alkoholem, tedy stavu opilosti, je-li dávka alkohol je příliš vysoký, může dojít k alkoholickému kómatu, které může vést k paralýze dýchání a dokonce ke smrti. smrt.
Reference
- T. NA. Geissman. (1974) „Principles of Organic Chemistry“ Druhé vydání. Redakce Reverté, S.A. ISBN: 8429171800
- Ahumada-Cortez, J. G., Gámez-Medina, M. E. a Valdez-Montero, C. (2017). Konzumace alkoholu jako problém veřejného zdraví. Ra Ximhai, 13(2), 13-24.
- Morrison, R. T. a Boyd, R. N. (1998). Organická chemie. Pearsonovo vzdělání.
- Weininger, S. J. a Stermitz, F. R. (1988). Organická chemie. obrátil jsem se.
Postupujte s:
- Ethylalkohol
- Paliva
- organická chemie


