30 Příklady binárního prodeje
Příklady / / November 09, 2023
The binární soli (neutrální soli) vznikají spojením kovu a nekovu. jsou chemické sloučeniny tvořena pouze dvěma chemické prvky. Například: chlorid sodný (NaCl) a bromid draselný (KBr).
- Viz také: Kovy a nekovy
Příklady binárních solí
- Chlorid sodný (NaCl)
- Chlorid železitý (FeCl2)
- Chlorid železitý (FeCl3)
- Sulfid kobaltnatý (CoS)
- Sulfid kobaltnatý (Co2Ano3)
- Sulfid olovnatý (PbS)
- Sulfid olovnatý (PbS2)
- Chlorid vápenatý (CaCl2)
- Fluorid sodný (NaF)
- Chlorid lithný (LiCl)
- Chlorid strontnatý (SrCl2)
- Chlorid barnatý (BaCl2)
- Chlorid hlinitý (AlCl3)
- Sulfid hořečnatý (MgS)
- Chlorid rubidium (RbCl)
- Bromid vápenatý (CaBr2)
- Sulfid draselný (K2S)
- Bromid hořečnatý (MgBr2)
- Sulfid zinečnatý (Zn2S)
- bromid lithný (LiBr)
- Chlorid nikelnatý (NiCl2)
- Chlorid uranatý (UCl3)
- bromid stříbrný (AgBr)
- Jodid stříbrný (AgI)
- Bromid draselný (KBr)
Názvosloví binárních solí
Podle tradiční nomenklatury se binární soli pojmenovávají tak, že se název nekovového prvku napíše s koncovkou -ide. Na druhé straně je název kovového prvku napsán podle jeho oxidačního stavu:
- Pro nejnižší oxidační stav se píše s koncovkou -oso. Například: chlorid železnatý (FeCl2), kde železo má oxidační stav 2+.
- Pro nejvyšší oxidační stav se píše s koncovkou -ico. Například: chlorid železitý (FeCl3), kde železo má oxidační stav 3+.
Podle systematické nomenklatury se binární soli pojmenovávají tak, že se název nekovového prvku napíše s předponou, která udává množství atomy tohoto prvku ve sloučenině. V názvu nekovového prvku je navíc umístěna koncovka -uro. Poté je umístěn název kovového prvku. Například: chlorid hořečnatý (MgCl2) a chlorid železitý (FeCl3).
Podle Stockovy nomenklatury se binární soli pojmenovávají tak, že se název nekovového prvku napíše s koncovkou -ide. Poté se umístí název kovového prvku a jeho oxidační stav zapsaný římskými číslicemi a v závorkách. Například: chlorid železitý (FeCl2) a sulfid kobaltnatý (Co2Ano3).
Aplikace binárních solí
- Používají se jako chladiva v potravinářském a farmaceutickém průmyslu. Například: chlorid vápenatý (CaCl2).
- Používají se k ošetření kovových povrchů proti korozi. Například: fluorid sodný (NaF).
- Používají se k regulaci vlhkosti v papírenském a stavebním průmyslu. Například: chlorid vápenatý (CaCl2).
- Používají se ve sklářském průmyslu k odstranění nečistot. Například: chlorid křemičitý (SiCl4).
- Používají se jako přísady do vaření. Například: chlorid sodný (NaCl).
Fyzikální vlastnosti binárních solí
- Mají vysoké body tání, protože se skládají z iontové vazby.
- Při rozpuštění nebo roztavení vedou elektrický proud.
- Nejběžnější soli mají nízkou tvrdost.
- Nejsou stlačitelné.
- Většina se může rozpustit ve vodě.
Jak se získávají binární soli?
Binární soli lze získat některými z následujících chemických reakcí:
Reakce mezi kovem a nekovem. Například: reakce mezi sodíkem (Na) a dichloridem (Cl2) produkuje chlorid sodný (NaCl).
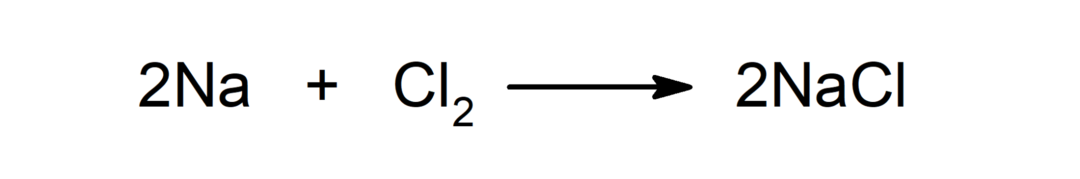
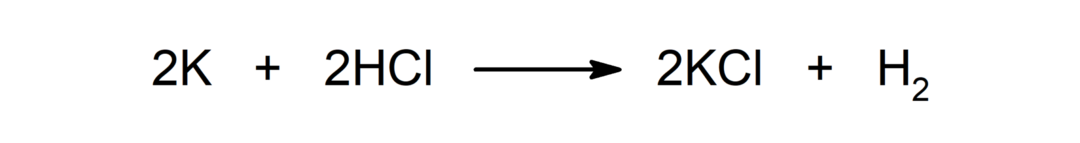
Reakce mezi kovem a kyselinou. Například: Reakcí mezi draslíkem (K) a kyselinou chlorovodíkovou (HCl) vzniká chlorid draselný (KCl) a dihydrogen (H2).
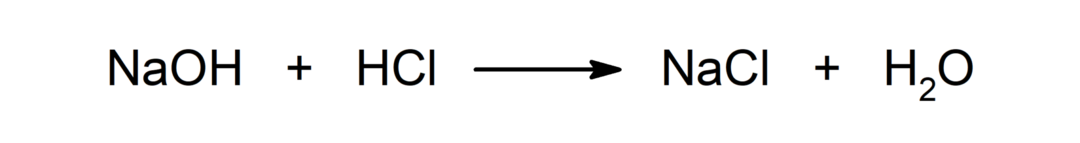
Reakce mezi kyselinou a zásadou. Například: Reakcí mezi kyselinou chlorovodíkovou (HCl) a hydroxidem sodným (NaOH) vzniká chlorid sodný (NaCl) a voda (H2BUĎ).
Postupujte s:
- oxysoli
- neutrální soli
- kyselé soli
Reference
- Cerón Villalba, A., Novoa Ramírez, C. S., & Alpizar Juárez, E. (2020). Nomenklaturní video 1: binární soli a chemická reakce.
- Acurio Arias, M. V. a Delgado Méndez, M. A. (2022). Herní výuková příručka pro „binární sloučeniny“ ve středoškolské chemii ve vzdělávací jednotce „Herlinda Toral“ (Bakalářská práce, Národní vysoká škola pedagogická).
- Cabrera, M. J. H. (2005). Studium prvních principů elektronových a strukturních vlastností binárních a ternárních sloučenin (doktorská disertační práce, University of La Laguna).



