Charakteristika halogenů
Chemie / / July 04, 2021
Halogeny jsou chemické prvky, které se nacházejí ve skupině VIIA nebo ve skupině 17 periodické tabulky. Skládá se z prvků fluoru, chloru, bromu, jodu a astátu.
Název halogen pochází z řečtiny a znamená „výrobce solí“, protože tyto prvky tvoří soli se sodíkem podobné běžné soli.
Společné vlastnosti halogenů:
Jsou to jednomocné prvky, to znamená, že mají pouze jedno valenční číslo. U halogenů je valence -1.
Mají afinitu k vodíku a tvoří takzvané hydracidy.
Mají malou afinitu ke kyslíku, takže netvoří oxidy, ale při velmi vysokých teplotách.
Spojují se s kovy za vzniku halogenových solí.
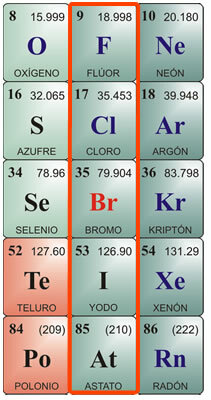
Jednotlivé vlastnosti halogenů:
Vlastnosti fluoru:
Chemický symbol F. Atomové číslo 9, atomová hmotnost 19. Fluor v čistém stavu je žlutý plyn s bodem tání -223 ° C a bodem varu -187 ° C. Neexistuje volně v přírodě, takže musí být izolován. Poprvé byl izolován v roce 1886. Jeho fyzikální vlastnosti jsou: Zelenožlutý plyn, Vysoce korozivní a dráždivý, s pronikavým zápachem, jedovatý pro člověka a zvířata. Je těžké zkapalnit. Chemické vlastnosti: Spojuje se s vodíkem, a to i při velmi nízkých teplotách s exotermickou reakcí. Spojuje se s kovy a tvoří soli. Rozkládá kyselinu chlorovodíkovou, produkuje chlor a rozkládá vodu a uvolňuje kyslík. Díky své afinitě k vodíku jej bere z organických látek a karbonizuje je. Jednou z jejích hlavních sloučenin je kyselina fluorovodíková, kterou lze skladovat pouze v nádobách z platiny nebo vosku, protože napadá oxid křemičitý ve skle. Je velmi těkavý a velmi korozivní. V kombinaci s kovy produkuje fluoridy.
Vlastnosti chloru:
Chemický symbol Cl. Atomové číslo 17, atomová hmotnost 35,5. Bod tání - 102 ° C, bod varu -37 ° C. Chlor byl objeven v roce 1774 a izolován v roce 1811. Fyzikální vlastnosti: Je to zelenožlutý plyn, který v přírodě neexistuje volně, protože se obecně vyskytuje v kombinaci se solemi. Má dusivý a jedovatý zápach. Chemické vlastnosti: Chlór je velmi podobný vodíku a při exotermické reakci vzniká kyselina chlorovodíková. Kyselina chlorovodíková, také nazývaná kyselina muriatic nebo dýmavá sůl, byla známá od starověkého Říma. Byl nalezen v plynném stavu na sopkách a rozpuštěn ve vodě některých řek poblíž sopek. Je velmi žíravý pro kůži a při požití jedovatý. Je produkován žaludkem pro trávení. Dalšími důležitými sloučeninami chloru jsou chlornany, zejména chlornan sodný, který se po rozpuštění ve vodě používá jako vodní bělidlo, dezinfekční prostředek a sterilant. Neutralizuje kyseliny.
Vlastnosti bromu:
Chemický symbol Br. Atomové číslo 35, atomová hmotnost 79,9. Bod tání -7,3 ° C, bod varu 58,8 ° C. V přírodě se nenachází volně, ale v kombinaci s kovy za vzniku bromidů. Izoluje se elektrolýzou. Fyzikální vlastnosti: Je to tmavě červená kapalina s dráždivým zápachem; při pokojové teplotě vydává dráždivou hustou oranžově červenou páru, která způsobuje kašel a slzení; Je to jedovaté. Rozpouští se v etheru nebo chloroformu a těžko se rozpouští ve vodě. Chemické vlastnosti: Brom napadá organické látky; u živých bytostí koroduje kůži a způsobuje vředy, které se obtížně hojí. Jeho hlavní použití je kombinováno s kovy tvořícími bromidy, které se používají pro průmyslové účely, jako je bromid stříbrný, dříve používaný ve fotografii. Používají se také v nízkých koncentracích jako antiseptikum. V kombinaci s vodíkem vede k kyselině bromovodíkové, bezbarvému plynu s pronikavým zápachem a chutí, který se používá hlavně k napadení kovů a získávání bromidů.
Vlastnosti Jód:
Chemický symbol I. Atomové číslo 53, atomová hmotnost 126,9. Teplota tání 113 ° C; bod varu 184 ° C. V přírodě neexistuje zdarma. Nachází se jako jodidy v postelích s mořskými řasami a jako součást minerálů v některých potravinách, jako je řeřicha, treskový olej a měkkýši. Fyzikální vlastnosti: Jód je pevné, krystalické tělo, černošedé barvy, s kovovým leskem, se silným a nepříjemným zápachem. Je špatně rozpustný ve vodě a velmi dobře rozpustný v alkoholu. Chemické vlastnosti: Spojuje se s kovy tvořícími jodidy; také s metaloidy, jako je síra a fosfor. Má vyšší afinitu ke kyslíku než ostatní halogeny. V kombinaci s amoniakem produkuje jodid dusíku, což je výbušný plyn. V kombinaci s vodíkem produkuje kyselinu jodovodíkovou, bezbarvý plyn s pronikavým zápachem a chutí, který kouří za přítomnosti vzduchu. Rozpouští se ve vodě a rozkládá se působením světla a tepla. Pokud molekula kyseliny obsahuje kyslík, vzniká kyselina jodová, což je krystalická pevná látka s oxidačními vlastnostmi. Jód se používá v alkoholickém roztoku jako dezinfekční a antiseptický prostředek.
Vlastnosti Astatus:
Na symbol. Atomové číslo 85, atomová hmotnost 210. V přírodě neexistuje zdarma. Teplota tání 254 ° C; bod varu 962 ° C Astat byl poprvé syntetizován ve 40. letech 20. století, protože se jedná o prvek, který se uvolňuje z rozkladu atomů vizmutu pomocí alfa paprsků. Je to radioaktivní prvek s velmi krátkou životností; nejdelší izotop je At210 s maximální životností přibližně 8 hodin. Jeho chemické vlastnosti jsou považovány za velmi podobné vlastnostem jódu; fyzicky by to mohlo mít vzhled a vlastnosti podobnější těm z kovů. Přestože je radioaktivním prvkem, nepředstavuje zdravotní riziko, protože se v přírodě běžně nevyskytuje. V laboratoři má pouze několik aplikací pro značení atomů při studiu subatomární hmoty.


