Příklad reaktivních materiálů
Chemie / / July 04, 2021
The Reaktivní materiály jsou látky, které při kontaktu s jinými mají sklon zahájit chemickou reakci. Na konci této reakce je výsledkem určité množství různých látek.
Reaktivita v látkách
The Reaktivita je kapacita látek komunikovat s ostatními v chemické reakci. Všichni účastníci této reakce se budou jmenovat Reaktivní. Když chemický jev skončí, nazývají se různé látky produkty.
V průmyslovém prostředí se reaktivita používá, kdykoli chcete generovat množství produktu chtěl. V průmyslových závodech se provádí výběr suroviny, která má ve svém složení vhodné reagencie, umístění v kontejneru zvaném Reactor, aby chemická reakce proběhla, a ujistěte se, že existuje ekonomický proces a účinný.
Jsou chvíle, kdy reakce bude to spontánní, a bude provedeno bez námahy, pouhým kontaktováním činidel. Bylo by zapotřebí pouze protřepat reagenty, aby se podpořilo jejich zabudování.
Jindy nebude stačit prostý kontakt činidel, ale bude nutné upravit podmínky procesu, buď přidání dalšího míchání do reaktoru, nebo zavedení ohřevu nebo dokonce chlazení, aby reakce začala a probíhala s lepší rychlostí a výkonem.
Reagenty se začnou zapojovat do generování Produktů, ale budou podle poměru která označuje rovnici, která vyjadřuje reakci, jako v následujícím:
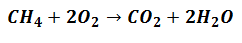
To znamená, že metanová činidla (CH4) a kyslík (O.2) budou smíšené v poměru 1 až 2 molekulární jednotky k vytvoření odpovídajících produktů.
Pokud je přidáno jedno z reagencií nejmenší množství který je požadován jako vypočítaný, bude volán Omezující reagencie, protože když se všechno spotřebuje, reakce se zastaví.
Druhá reagencie, které na konci reakce bude přebytek, bude volána Reaktivní v přebytku, a samozřejmě to přijde společně s produkty.
Reaktivita látek může být použita pro mnoho chemických jevů, jako např Oxidace, v případě manganistanu draselného; Katalýza, jako v případě platinového kovu s jemnou síťovinou; výměny elementů, jako v případě kovového zinku, který nahrazuje vodík v kyselinách.
Reaktivita jako vlastnost nebezpečných materiálů
The Reaktivita představuje a rizikový majetek když je reaktivní materiál již bez použití odpadem, je nejprve nalit do nádoby, která zajišťuje, že zůstane izolovaný od kontaktu s lidmi. Pokud je odpad pevný nebo kapalný, obvykle se jedná o silné plastové nádoby, které jsou povinně vybaveny štítkem s piktogram „Reagent Material“, což je obrázek s oranžovým pozadím a odpovídající symbolikou v černé barvě. Následující obrázek ukazuje paletu signálů pro různé typy reaktivity.

Reaktivita je jednou z vlastností CRETIB nebezpečného odpadu: Žíravý, reaktivní, výbušný, toxický, hořlavý a biologicky infekční. Ve skutečnosti je to nejreprezentativnější, protože všechny ostatní vlastnosti mají co do činění s režimem reaktivity.
Velmi častým případem, kdy je nebezpečí těchto materiálů vystaveno, je situace, kdy dojde k jejich rozlití. Pokud například dojde k úniku kyseliny sírové a dojde k jejímu rozlití na velmi velkou plochu, měl by být odstraněn personál, který nemá školení k řízení situace. Lidé vyškolení v tomto musí zasáhnout.
Postup k odstranění nebezpečné situace začíná tím, že se na místo navštívíte s příslušnými osobními ochrannými prostředky. Identifikujte a izolujte oblast úniku reaktivního materiálu a začněte působit proti jeho reaktivitě s jinými chemicky odlišnými druhy. V tomto případě působí kyselina sírová jako kyselina. Tuto reaktivitu bude možné uhasit pouze pomocí druhů, jako je hydroxid sodný, jedna z nejmocnějších bází.
Reakce mezi kyselinou a bází se nazývá neutralizace. S pomocí tohoto jevu bude reaktivita kyseliny sírové v úniku směřována k aktivitě hydroxidu sodného.
Přijde čas, kdy hydroxid sodný, také reaktivní materiál, ukončí nebezpečnost kyseliny sírové. Když reakce skončí, půjde pouze o ředění produktů velkým množstvím vody.

Příklady reaktivních materiálů
- Hydroxid sodný
- Hydroxid vápenatý
- Hydroxid hořečnatý
- Kyselina sírová
- Kyselina chlorovodíková
- Kyselina dusičná
- Sírovodík
- Dusičnan draselný
- Hydrogenuhličitan sodný
- Oxid uhličitý
- Oxid siřičitý
- Oxid siřičitý
- Plynný vodík
- Plynný kyslík
- Plynný chlor
- Plynný brom
- Kovové lithium
- Kovový sodík
- Kovové cesium
- Kovový hořčík
- Dusičnan amonný
- Chlorid sodný
- Chlorid draselný
- Chlorid vápenatý
- Manganistan draselný
- Manganistan sodný
- Kovová platina
- Kovový zinek
- Karbid vápníku
- Acetylén
- Metan
- Etan
- Propan
- Butan



