Příklad objemové analýzy
Chemie / / July 04, 2021
Na Analytická chemie„ Objem je analytická metoda, která se skládá z Měření objemu reagencie potřebné k stechiometrické reakci s analytem, což je látka, která má být stanovena.
Reagujte stechiometricky se týká látek chemicky interagujících podle podíl, který označuje chemickou rovnici již vyvážený.
Volá se látka, která má být zkoumána Analyt. Z této látky bude jako vzorek odebrán známý a přesně změřený objem, který budeme nazývat Alikvotní, obsažené v Erlenmeyerově baňce pro zahájení analýzy.
Koncepty objemové analýzy
Volumetrická analýza jako typ Chemický rozbor, nosit zahrnoval chemickou reakci. Tato chemická reakce bude probíhat mezi vzorkem s neznámým množstvím zkoumané látky a známým množstvím jiné látky schopné reagovat s první látkou.
The Reakční látky budou ve vodném roztokuBudou měřeny objemy roztoků, které interagovaly, aby dosáhly konce reakce, což bude viditelné díky indikátoru, který dá barvu uvnitř baňky.
Při volumetrické analýze je vodný roztok Známá koncentrace se nazývá standardní řešení
, Standard nebo Titrant, a bude sloužit jako reference pro ukončení reakce k provedení výpočtu, který odhalí množství zkoumané látky.Tento postup reakce obou řešení se nazývá Chemický stupeň o Oceňování, které je základní součástí volumetrické analýzy. Skládá se z cesty postupné nalévání standardního řešení (Titrant) v alikvotní části (Ukázka), dokud indikátor neukáže změnu s barevným rozdílem.
A Indikátor Jedná se o chemickou látku, která se přidává do alikvotního podílu a vykazuje zbarvení a která po skončení reakce změní barvu.
Volumetrická analýza se skládá z jednoduché série kroků:
1. - Příprava standardního roztoku
2. - Příprava vzorku nebo alikvotního podílu
3. - Chemický stupeň
4. - Měření objemu
5. - Výpočet zkoumané látky.
Do té míry, že už mají plně reagoval tyto dvě látky se tomu říká Bod ekvivalence.
Jako v každé chemické metodě analýzy, i v objemové analýze existují požadavky na dobré výsledky:
- Chemická reakce musí být SelektivníTo znamená, že standardní roztok bude reagovat pouze se vzorkem.
- Chemická reakce musí být Stechiometrický, tj. poslouchat proporce vyznačené ve vyvážené chemické rovnici.
- Chemická reakce musí být Kvantitativní; označuje dokončení 99,9% v bodě ekvivalence.
-Musí být detekovatelný koncový bod v reakci, což bude lépe potvrzeno indikátorem.
Primární vzor
The Primární vzory Jsou to látky vysoké čistoty, jejichž koncentrace v roztoku se počítá přímo z odváženého množství a použitého objemu vody.
A) Ano, lze reagovat pracovními řešeními, znát jejich koncentrace a převádět je na standardní roztoky.
Příklady primárních vzorů jsou:
Uhličitan sodný (Na2CO3): Používá se ke standardizaci kyselin, jako je kyselina sírová.
-Biftalát draselný: Primárním standardem je příprava standardních roztoků zásad, jako je hydroxid sodný.
Chlorid sodný (NaCl): Používá se ke standardizaci roztoků dusičnanu stříbrného.
- Uhličitan vápenatý (CaCO3): Primární standard pro EDTA (kyselina ethylendiamintetraoctová).
Primární vzor musí splňovat několik základních charakteristik:
Musí mít Vysoká čistota, Atmosférická stabilita, Absence hydratační vody, Nízké náklady a snadné získání, Y Vysoká ekvivalentní hmotnost.
Klasifikace objemové analýzy
V závislosti na chemických druzích, s nimiž se analýza používá, to bude typ odměrky:
Acidobazická volumetrie: Funguje, ať už s kyselinou nebo s bází, na analýzu vzorků, které obsahují kyseliny nebo zásady.
Objem srážek: Také se nazývá Argentometry, používá standardní roztok dusičnanu stříbrného k určení, kolik chloridů je ve vzorku.
Objemová složitost: Standardní roztok komplexotvorného činidla, jako je EDTA, se používá k měření koncentrace tvrdosti, tj. Uhličitanu vápenatého a hořečnatého, ve vodě.
Volumetrie REDOX: K reakci dochází mezi oxidující látkou a redukční látkou.
Indikátory
Z mnoha indikátorů používaných ve Volumetrics vynikají tři:
1.- Methylová oranžová: V alikvotní části trvá oranžové zbarvení, které bude titrováno kyselinou. Po dosažení bodu ekvivalence indikátor zezelená.
2.- Fenolftalein: Na začátku je to v alikvotní části transparentní, která bude mít název se základnou. Po dosažení bodu ekvivalence indikátor zčervená.
3.- Eriochromová černá: Je to indikátor používaný ke stanovení tvrdosti vody. Na začátku je v alikvotní části fialová, dokud není titrována komplexotvorným činidlem. Na konci reakce zmodrá.

Nástroje v objemové analýze
V objemové analýze bude použita řada nástrojů, které, pokud nejsou k dispozici, nelze adekvátně vyvinout:
1. - Odměrná baňka: Je to nádoba podobná baňce ve spodní části, zploštělá dole, která má tenký sloupec, do kterého se přidává kapalina. Má značku, která označuje, kde by měl být meniskus kapaliny, takže pokrývá přesný objem. Používá se k obsazení standardních řešení; díky přesnosti svého objemu je zajištěna známá koncentrace.

2. - Pipety: Jedná se o tenké odměrné zkumavky, které umožňují spolehlivě měřit přesná množství kapaliny. Jsou k dispozici až do 25 mililitrů a umožňují přesný odběr vzorků.
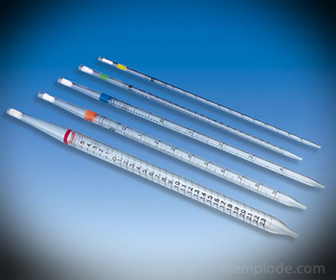
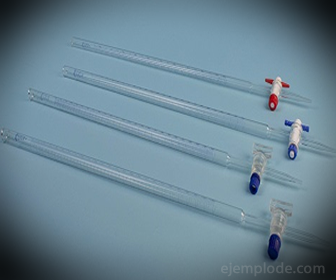
3. - Byreta: Je to podlouhlá trubice o objemu 50 mililitrů, která bude obsahovat standardní roztok. Na jednom ze svých konců má ventil regulující průtok, který vypustí roztok do alikvotní části.
4. - Erlenmeyerovy baňky: Jsou to nádoby s plochým dnem, kuželovitého tvaru, které končí válcovým okrajem. Tato konstrukce je činí vhodnými pro chemické titrace, protože neumožňují třepání roztoků, aby je přetékaly. Aby bylo možné zajistit spolehlivý výsledek, budou pro opakované testování vyžadovány minimálně tři.

Výpočty v objemové analýze
Při manipulaci s vodnými roztoky jsou důležitými veličinami pro objemovou analýzu koncentrace a objem.
Hlavní rovnice volumetrie je založena na čtyřech hlavních datech:
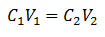
C1= Koncentrace vzorku (neznámá)
PROTI1= Objem alikvotu, se kterým byla analýza zpracována
C2= Koncentrace standardního roztoku použitého k dosažení bodu ekvivalence
PROTI2= K dosažení reakce je zapotřebí objemové standardní řešení
Data jsou v rovnici nahrazena, přičemž neznámá je pouze hledaná koncentrace. Všechna data musí být samozřejmě na stejných jednotkách.
Příklady objemové analýzy
Stanovení chloridů (Cl-) argentometrií s dusičnanem stříbrným.
Stanovení bromidů (Br-) argometometrií s dusičnanem stříbrným.
Stanovení kyanidů (CN-) argentometrií s dusičnanem stříbrným.
Stanovení uhličitanu hořečnatého (MgCO3), pomocí komplexometrie, s EDTA.
Stanovení uhličitanu vápenatého (CaCO3), pomocí komplexometrie, s EDTA.
Analýza kyseliny sírové (H2SW4) s hydroxidem sodným (NaOH).
Analýza hydroxidu sodného (NaOH) s kyselinou chlorovodíkovou (HCl).
Stanovení antimonu (III) manganistanem draselným (KMnO4).
Stanovení arsenu (III) manganistanem draselným (KMnO4).
Stanovení titanu (III) manganistanem draselným (KMnO4).
Stanovení molybdenu (III) manganistanem draselným (KMnO4).
Stanovení železa (II) manganistanem draselným (KMnO4).
Stanovení oxalátového iontu manganistanem draselným (KMnO4).
