Příklad chemické energie
Chemie / / July 04, 2021
The Chemická energie je ta, která pochází z chemických reakcí. Interakce mezi chemickými látkami generuje rozbití a / nebo tvorbu vazeb, což znamená uvolnění nebo absorpci energie. Chemická energie se nazývá uvolněná energie, kterou lze použít například jako tepelná energie a elektrická energie.
Energie v chemických reakcích
Chemickou energii lze získat v maximálním vyjádření ze dvou hlavních zdrojů: spalování a elektrolytická řešení. Na druhé straně na úrovni lidského těla je možné získat energii chemickým rozpadem potravy.
Energie spalování
Například když je Fuel Methane CH4, nejjednodušší uhlovodík, začíná hořet v přítomnosti Oxygen Oxidizer, rozpadne se a vytvoří produkty oxidu uhličitého CO.2 a voda H2NEBO. Navíc narušení vazeb atomů vodíku s atomy uhlíku uvolní energii ve formě tepla.
CH4 (g) +202 (g) → CO2 (g) + 2H2 O (l) ∆H = -212,8 kcal / mol
Rovnice spalování metanu. Teplo této reakce je reprezentováno ΔH. Záporné znaménko označuje uvolnění energie. Reakce je exotermická.
 Spalování metanového plynu. Reakce se projevuje plamenem.
Spalování metanového plynu. Reakce se projevuje plamenem.
Příklady hořících spalin organických sloučenin při 25 ° C
Sloučenina |
Vzorec |
ΔH (Kcal / mol) |
Metan (g) |
CH4 |
-212.80 |
Ethan (g) |
C2H6 |
-372.82 |
Propan (g) |
C3H8 |
-530.60 |
n-butan (g) |
C4H10 |
-687.98 |
n-pentan (g) |
C5H12 |
-845.16 |
Ethylen (g) |
C2H4 |
-337.23 |
Acetylen (g) |
C2H2 |
-310.62 |
Benzen (g) |
C6H6 |
-787.20 |
Benzen (l) |
C6H6 |
-780.98 |
Toluen (l) |
C7H8 |
-934.50 |
Naftalen (y) |
C10H8 |
-1,228.18 |
Sacharóza (y) |
C12H22NEBO11 |
-1,348.90 |
Metanol (l) |
CH3Ach |
-173.67 |
Ethanol (l) |
C2H5Ach |
-326.70 |
Kyselina octová (l) |
CH3COOH |
-208.34 |
Kyselina benzoová |
C6H5COOH |
-771.20 |
Aby palivo poskytovalo veškeré spalné teplo, kterého je schopné, musí být v plynném stavu. Jak je vidět v tabulce, kapalný benzen přispívá spalovacím teplem, které je o 6,22 kcal / mol méně než teplo uvolňované plynným benzenem. To znamená, že k přechodu z kapaliny na plyn je třeba investovat 6,22 kcal / mol.
Kliknutím zobrazíte další informace na webu Paliva.
Elektrolytická řešení Energie
Elektrolytický vodič je médium, ve kterém je zapojen jeden nebo více iontových druhů, což je rozptýleno svým elektrickým nábojem, což umožňuje průchod elektrického proudu Ústava. Elektrolytická řešení jsou elektrolytické vodiče.
Mezi elektrolytické vodiče patří kromě roztoků elektrolytů také Roztavené soli a také některé pevné soli, jako je chlorid sodný NaCl a dusičnan stříbrný AgNO3.
K přenosu elektronů dochází iontovou migrací, kladnou i zápornou, směrem k elektrodám. Tato migrace zahrnuje nejen přenos elektřiny, ale také transport hmoty z jedné části vodiče do druhé.
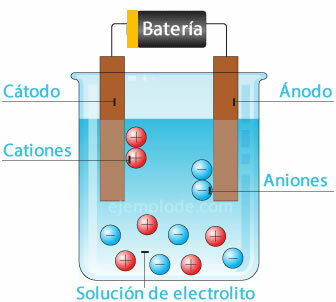 Elektrochemický článek
Elektrochemický článek
Připojení potenciálního zdroje ke kovovým elektrodám (katodě a anodě) a jejich ponoření do a Vodný roztok, elektrony budou cestovat anodou, aby unikly z roztoku na kladný pól kašna. To je například případ chloridového iontu, který se uvolňuje z jeho elektronu, a již s neutrálním nábojem se připojí k dalšímu atomu chloru a vytvoří diatomickou molekulu. Z roztoku unikne plynný chlór.
2Cl- = 2Cl + 2e-
Elektrony opouštějící záporný pól zdroje budou umístěny v ponořené katodě. Druhy přítomné ve vodném roztoku (ionty) vezmou elektrony z katody. Například vodíkové ionty, které tvoří vodu, byly kladně nabité elektron, který má být neutralizován, a spojen s dalším atomem vodíku za vzniku molekuly křemelina. Bude unikat jako plynný vodík z roztoku.
2H+ + 2e- = 2H
2H = H2 (G)
Tato výměna elektronů může podporovat provoz autobaterií, které se skládají z elektrod olova Pb ponořených do roztoku kyseliny sírové H2SW4.
Stejná energie se získává u všech typů baterií, s nimiž se manipuluje na domácí úrovni: 9 V, AA, AAA, D, abychom jmenovali jen několik příkladů.
Energie potravin
Lidské bytosti asimilují energii, která se uvolňuje rozpadem jídla, které jíme v našem těle. Tato energie je to, co naše tělo používá k nevědomým funkcím (trávení, srdeční rytmus, buněčné funkce) a těm, které provádíme.
Pokud nemáte intenzivní fyzickou aktivitu a váš metabolismus je pomalý, doporučuje se pravidelný kalorický příjem, protože potraviny s vysokým obsahem Složité lipidy a uhlohydráty, které mají velmi velké struktury, se obtížněji rozkládají, což vede k obrácení Energie. V takovém případě by byl účinek na okamžik opačný.
Je vhodné konzumovat ovoce, když musíte pracovat v noci, protože ovoce obsahuje fruktózu, jednoduchý sacharid, který se snadno rozkládá a bude mít k dispozici energii po vašem spotřeba.
Chemická energie a její transformace
Termoelektrické elektrárny
Těžká paliva se v termoelektrických elektrárnách používají k dosažení vysoké a dlouhodobé výhřevnosti. Obecně se jedná o topný olej (topný olej). Spalování, které je chemickou fází procesu, bude sloužit jako topné činidlo pro kotel, který bude generovat nasycenou páru. Tato pára bude vystupovat pod tlakem parní distribuční sítí a začne pohybovat turbínami generátoru. Tato zařízení budou vyrábět elektrickou energii pro zásobování odpovídající populace.
Chemická energie → Mechanická energie → Elektrická energie
Automobilový provoz
Automobily jsou závislé na zdroji energie, kterým je baterie. V baterii je již známo, že dochází k elektrolytickému vedení, které napájí zapalovací systém, příslušenství palubní desky a pomocné elektrické zásuvky. Díky této dostupné elektřině bude vůz schopen se přesunout a odvézt řidiče na požadované místo.
Chemická energie → Elektrická energie → Mechanická energie
