Příklad organické chemie
Chemie / / July 04, 2021
The Organická chemie Je součástí obecné chemie odpovědné za studium a funkční klasifikaci chemických sloučenin, jejichž strukturním prvkem je Uhlík, přítomný v hojném počtu v Živá hmota; Vzniká tak velmi diferencovaný vesmír anorganické chemie, věnovaný chemickým sloučeninám klasifikovaným jako minerály.
Atom uhlíku má v poslední skořápce své elektronické konfigurace čtyři elektrony. Tato vlastnost spolu s atomovým poloměrem umožňuje, aby byla spojena kovalentními vazbami k jiným atomy stejného prvku v mnoha řetězcích, které tvoří velkou rozmanitost chemických sloučenin stabilní.
Můžeš zkontrolovat Kovalentní vazby.
Takové chemické sloučeniny kromě atomů uhlíku, které jim dodávají prvotní strukturu, obsahují atomy vodíku jako hlavní doplněk uhlíkové valence. Navíc v této rozmanitosti sloučenin existují ty, které zasahují atomy kyslíku, Dusík, halogeny, síra a dokonce i fosfor, prvky alkalických kovů a kovů alkalických zemin a kovy z přechod. V závislosti na tom, kdo je do molekuly zapojen, budou to fyzikální a chemické vlastnosti konečné látky.
The organické sloučeniny jsou přítomny po celém světě Živá hmota; podporovat a udržovat všechny biologické funkce, na rozdíl od anorganických nebo minerálních látek, které lidé používali ke komerčním účelům, k experimentům nebo k plnění určitých domácích úkolů.
Dějiny organické chemie
Před rokem 1828 se již rozlišovalo mezi organickou chemií a anorganickou chemií. Organická hmota byla spojena s vytvořením prostřednictvím a "životní síla"a anorganické s neživými, s minerály. Vzhledem k těmto koncepcím nelze očekávat, že v laboratoři získáme organické sloučeniny z anorganických materiálů.
Nicméně, v roce 1828 Friedrich Wöhler (1800-1882) se podařilo připravit organickou látku, Močovina CO (NH2)2, důležitý produkt živočišného metabolismu, z anorganických sloučenin. Léčba Olovo kyanát Pb (CNO)2 s Amoniak NH3 dostat Kyanát amonný NH4CNO; Tato sloučenina skutečně vznikla, ale když se roztok vařil, aby krystalizoval kyanát amonný, přeměnil se na močovinu.
Tato chemická změna je příkladem Interní přeskupení, ve kterém se nemění počet nebo třída atomů v molekule, ale pouze jejich pořadí v ní. Tyto typy transformací jsou v organické chemii velmi běžné.
Wöhlerův objev zahájil opuštění teorie životní síly později zcela zlikvidován následován přípravou mnoha dalších organických sloučenin v EU laboratoř. Navzdory tomu existují kvalifikace Anorganic and Organic, protože anorganické sloučeniny se vztahují k minerálním produktům a organické sloučeniny, které jsou ve skutečnosti sloučeninami uhlíku a vodíku a jejich deriváty, jsou typu produkovaného živými organismy.
Ačkoli zákony obecné chemie platí stejně pro obě sloučeniny, různé příčiny ospravedlňují a činí toto rozdělení nezbytné. Organické a anorganické sloučeniny se tedy liší v různých vlastnostech, například: jejich Rozpustnost s výhodou v organických rozpouštědlech (ether, alkohol, chloroform atd.) a ve vodě Stabilita (organické sloučeniny se rozkládají při relativně nízkých teplotách) a Povaha reakcí; pro anorganické sloučeniny jsou iontové, jednoduché a prakticky okamžité a pro organické sloučeniny jsou kovalentní, komplexní a pomalé.
Organické sloučeniny
Uhlíkové sloučeniny s řetězci až do devadesáti atomů jsou známé. The řetězy Atomy uhlíku mohou být lineární a rozvětvený a mají jednoduché kovalentní vazby nebo mají dvojné nebo trojné vazby. Je známo více než 2 500 sloučenin, které obsahují pouze uhlík a vodík (Uhlovodíky).
Izomerismus organických sloučenin
V anorganických sloučeninách vzorec obecně představuje jedinou sloučeninu; tedy existuje pouze jedna látka vzorce H2SW4. Molekula kyseliny sírové obsahuje dva atomy vodíku, jeden ze síry a čtyři z kyslíku, ve zvláštním a jedinečném uspořádání. V organických sloučeninách to je vzácné, aby se to stalo. Tak například existují dvě sloučeniny, které reagují na vzorec C.2H6Nebo ethylalkohol nebo ethanol a dimethylether.

Čím složitější je molekula, tj. Čím větší je počet atomů uhlíku, tím větší je počet možných izomerů.
Analýza organických sloučenin
Analýza organické sloučeniny zahrnuje: kvalitativní analýza„ kvantitativní analýza a Funkční analýza. V případě, že se předpokládá, že sloučenina je v nečistém stavu, je dříve čištěna pomocí Krystalizace, Destilace, Sublimace, Extrakce, atd. Kritérium čistoty lze posoudit na základě jeho fyzikálních konstant, jako je teplota tání, teplota varu, hustota, rozpustnost, krystalická forma, index lomu atd.
The kvalitativní analýza Ověřuje se zkoumáním přítomnosti prvků, které tvoří sloučeninu, zejména uhlíku, vodíku a dusíku a někdy i halogenů, síry a fosforu.
The kvantitativní analýza Provádí se za použití metod používaných pro kvalitativní analýzu. Výchozím bodem je určité množství látky, která prochází spalováním, a oxid uhličitý se shromažďuje a váží. uhlík a vodní pára vytvořené pro výpočet procenta uhlíku a vodíku v sloučenina. Výsledky kvantitativní analýzy usnadňují výpočet empirický vzorec, ačkoli molekulární vzorec lze nalézt až po stanovení molekulové hmotnosti látky. Problém však ještě není vyřešen, protože stejný molekulární vzorec může odpovídat různým izomerům.
Klasifikace organických sloučenin
Podle jejich struktury se organické sloučeniny dělí na sloučeniny alifatický, aromatický Y heterocyklický. Alifatické sloučeniny jsou příbuzné metanu CH4, jsou otevřené řetězce, s výjimkou cykloparafinů, a za svůj název vděčí skutečnosti, že do této skupiny patří živočišné a rostlinné tuky.
The aromatické sloučeniny, uzavřený řetězec, úzce souvisí s benzenem, C.6H6, a za své jméno vděčí skutečnosti, že mnoho z nich má voňavé, příjemné vůně.
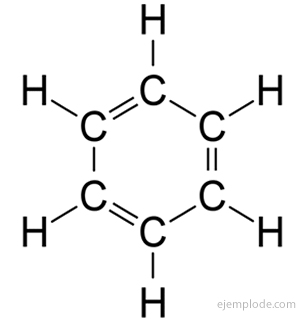
Benzenový kruh
The heterocyklické sloučeniny Jsou to sloučeniny s uzavřeným řetězcem, jejichž kruh obsahuje jiný prvek než uhlík.
Vzhledem k jejich ústavě jsou to:
Uhlovodíky, což je zase kvůli typu odkazů, které má, klasifikováno jako Alkany, Alkenes Y Alkyny. Kromě toho do této kategorie patří cykloalkany, benzen a jejich deriváty složené pouze z uhlíku a vodíku.
Heterocyklické sloučeniny
Halogenované deriváty:R-X
Nitrosloučeniny:R-NO2
Kyseliny sulfonové:R-SO3H
Nitrily (OR alkylkyanidy) a izonitrily:R-CN a R-NC. Liší se tím, jak je atom dusíku vázán v molekule.
Alkoholy:R-OH
Fenoly: Sloučeniny na bázi páteře sestávající z benzenového kruhu s přidanou hydroxylovou skupinou.

Etherové:R-O-R
Merkaptany: R-SH
Thioethery:R-S-R
Thiokyseliny:R-COSH
Aldehydy:R-CHO
Ketony:R-CO-R
Karboxylové kyseliny:R-COOH
Jdete ven:R-COOM (M pro kov)
Estery: R-COO-R
Anhydridy: R-CO-O-OC-R
Miny:R-NH2, R-NH-R, 2R-N-R
Sacharidy typu Aldosa:-CHOH-CHOH-CHO
Sacharidy typu ketózy:-CHOH-CO-CH2Ach
Organokovové sloučeniny:R-M-R
Metal-alkylhalogenidy:R-MX (také známé jako Grignardova činidla)
