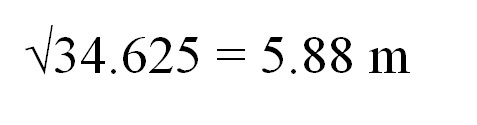Příklad konverzí v termodynamice
Fyzika / / July 04, 2021
Rozdíl mezi teplem a teplotou: Teplo je energie, která prochází z jednoho těla do druhého, zatímco teplota je mírou kinetické energie každé molekuly.
Tepelná rovnováha: Je to okamžik, ve kterém dvě nebo více těles různých teplot dosáhnou rovnováhy v důsledku přenosu tepelné energie z jednoho z nich, dokud nedosáhnou stejné teploty.
Absolutní termometrické váhy
Absolutní teplota: Je to míra průměrné kinetické energie každé molekuly měřená ve stupních Kelvina.
Celsia: Jedná se o měření ve stupních teploty založené na bodu tání (0 ° C) a bodu varu (100 ° C) vody v 1 atmosféře.
Fahrenheita: Jedná se o opatření ve stupních teploty, které navrhuje (32 ° F) pro bod tání a (212 ° F) pro bod varu vody v 1 atmosféře.
Kelvin: Vychází z nejnižší dosažitelné teploty (absolutní nula) a odpovídá - 273 ° C = 0 ° K a její stupnice je Celsius.
Rankine: Je založen na nejnižší teplotě, kterou lze v tělese dosáhnout (absolutní nula), ale v tomto případě bude stupnice stejná jako stupnice ve stupních Fahrenheita a odpovídá - 460 ° F = 0 ° R
|
Převod ° F na ° C ° C = 5/9 (° F-32) |
Převod ° C na ° F ° F = 9/5 (° C) +32 |
|
Přepočet ° K na ° C ° C = ° K -273 |
Přepočet ° C na ° K ° F = ° C + 273 |
|
Převod ° K na ° F ° F = 9/5 (° K -273) + 32 |
Převod ° F na ° K. ° K = 5/9 (° F-32) +273 |
PŘÍKLAD PŘEVODU:
Pacient v nemocnici dosáhl tělesné teploty 40 ° C, chcete znát tuto teplotu ve stupních Fahrenheita, Rankina a Kelvina.
Nejprve je určen vztah mezi stupni Celsia a ostatními stupnicemi.
° K = ° C + 273 = 40 + 273 = 313 ° K.
° F = 9/5 (° K -273) + 32 = 9/5 (313-273) + 32 = 104 ° F
° R = ° F + 460 = 104 + 460 = 564 ° R
Horký: Je to energie, která přechází z jednoho těla do druhého, když má jinou teplotu. Teplo je příčinou a teplota účinkem. Jeho jednotkami jsou:
Kalorie: Množství tepla potřebné ke zvýšení teploty o 1 ° C gramu vody.
Kilokalorie: Teplo potřebné ke zvýšení teploty o 1 ° C kilogramu vody.
B.T.U: Množství tepla pro zvýšení teploty o 1 ° F libry vody.
Joule: Známý jako mechanický ekvivalent tepla a rovná se: 1 cal = 4,18 J
Specifická tepelná kapacita: Je to množství tepla, které tělo podporuje nebo může vydávat.
Specifické teplo: Jedná se o nutné teplo aplikované na jednotku hmotnosti ke zvýšení její teploty o 1 ° C.
Latentní teplo: Je to teplo, které musí být dodáno do kg látky při transformační teplotě, aby se změnil její stav.
Q = kal
m = kg
Cl = kcal / kg
Cl= Q / m
PŘÍKLAD PROBLÉMU LATENTNÍHO TEPLA:
Vypočítejte latentní teplo tělesa o hmotnosti 2,3 kg, které produkuje sílu 245 N na vzdálenost 12 m.
Nejprve určete práci, která se provádí.
W = Fd = (245 N) (12 m) = 2490 J
Jakmile je práce získána v Joulech, jsou transformovány na kalorie s následujícím vztahem:
1 kal - 4,81 J
x cal - 2490 J
x cal = (1 cal) (2490 J) / 4,81 J = 517,64 cal
Nakonec je výsledek tepla dosazen do rovnice latentního tepla:
Cl= Q / m = 517,67 kal. / 2,3 kg = 225,03 kal. / Kg
Teplo fúze: Je to množství tepelné energie potřebné k roztavení jednotkové hmotnosti pevné látky. Stejné množství tepla musí vyzařovat, když látka tuhne.
Výparné teplo: Je to množství energie potřebné k oddělení molekul obsažených v jednotce hmotnosti a změně látky z kapalné fáze na parní fázi.