20 Eksempler på kemiske fænomener
Miscellanea / / July 04, 2021
Det kemiske fænomener (eller kemiske reaktioner) er de fænomener, hvor der sker ændringer i stof, og der dannes nye stoffer kaldet "produkter", og andre kaldet "reaktanter" nedbrydes. For eksempel: trærot, papirforbrænding, kompostering.
Kemiske reaktioner kan være spontan (reaktioner, der opstår uden behov for energi eller katalysatorer) eller ikke spontan (reaktioner, der har brug for bidrag fra energi, katalysatorer eller en eller anden ekstern intervention for at forekomme). Mange gange, for at en reaktion skal forekomme, er det nødvendigt, at reagenserne har en temperatur specifik, a pH en indstillet trykværdi osv.
Det kan også være vigtigt at kontrollere hastighed som kemiske reaktioner opstår. Det katalysatorer De er stoffer, der føjes til en kemisk reaktion for at øge dens hastighed, mens inhibitorer er stoffer, der nedsætter hastigheden af kemiske reaktioner. Andre faktorer, der påvirker hastigheden af en kemisk reaktion, er temperatur, tryk, koncentrationen af reaktanter og selve reaktionens art.
Det kan tjene dig:
Typer af kemiske fænomener
Kemiske reaktioner kan være:
Uorganiske reaktioner. Intervenere uorganiske forbindelser og kan klassificeres i henhold til:
- Den forstand, hvor reaktionen opstår.
-
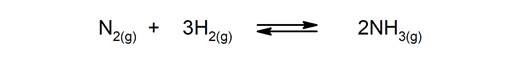
Reversible reaktioner. De forekommer begge veje, så produkterne kan nedbrydes og danne reaktanterne igen.
-
Irreversible reaktioner. De sker kun på en måde.

-
Reversible reaktioner. De forekommer begge veje, så produkterne kan nedbrydes og danne reaktanterne igen.
- Den type partikel, der reagerer.
-
Syre-base reaktioner. H ionoverførsel forekommer+.

-
Oxidationsreduktionsreaktioner. En af reaktanterne oxiderer (øger antallet af oxidation), mens den anden reduceres (dens oxidationstal falder). I disse reaktioner forekommer elektronoverførsel.

-
Syre-base reaktioner. H ionoverførsel forekommer+.
- Reaktionshastigheden.
-
Hurtige reaktioner. De forekommer på meget kort tid.
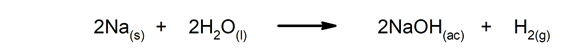
-
Langsomme reaktioner De tager lang tid at gennemføre.
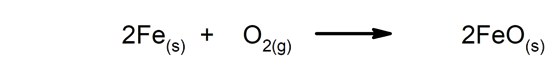
-
Hurtige reaktioner. De forekommer på meget kort tid.
- Formen for den energi, den udsender eller absorberer.
-
Eksoterme reaktioner. Når de opstår, frigiver de varme.
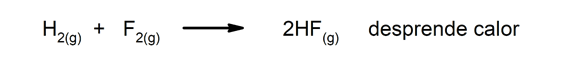
-
Endotermiske reaktioner. Når de opstår, absorberer de varme.

-
Eksoluminøse reaktioner. Når de forekommer, udsender de lys.

-
Endoluminøse reaktioner. For at ske, har de brug for lys.

-
Eksoterme reaktioner. Når de opstår, frigiver de varme.
- Typen af transformation.
-
Syntese eller additionsreaktioner. To stoffer kombineres for at danne et nyt stof.
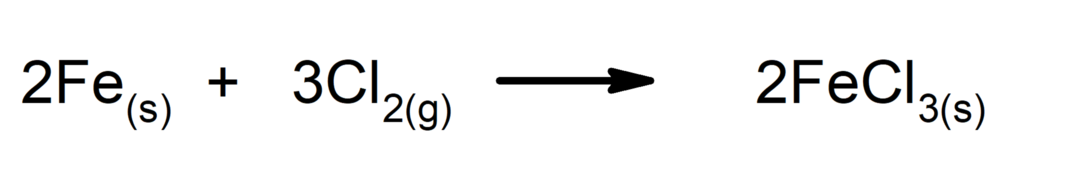
-
Nedbrydningsreaktioner. Et eller flere stoffer nedbrydes i deres enkleste bestanddele.
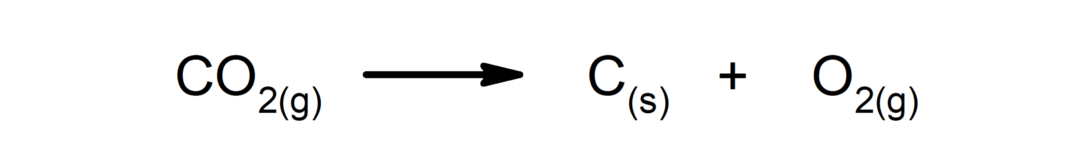
-
Forskydnings- eller substitutionsreaktioner. Et element eller en forbindelse erstatter et andet i en forbindelse og frigiver det.
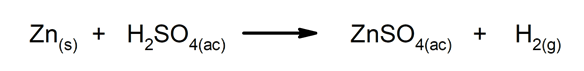
-
Dobbelt substitutionsreaktioner. To forbindelser udveksler grundstoffer eller forbindelser på samme tid.

-
Syntese eller additionsreaktioner. To stoffer kombineres for at danne et nyt stof.
Organiske reaktioner. De er reaktioner, hvor organiske forbindelser griber ind. De har mange klassifikationer baseret på typen af organisk forbindelse, der reagerer, og den type reaktion, den gennemgår. Nogle eksempler er:
-
Halogenering af alkaner. Et hydrogen er substitueret med a alkan af et halogen.
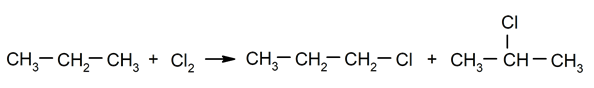
-
Forbrænding af alkaner. En alkan reagerer med ilt for at generere kuldioxid og vand, hvis forbrændingen er fuldstændig.
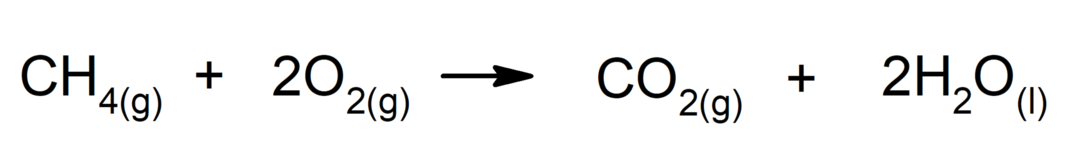
-
Halogenering af alkener. Halogener er substitueret med et eller begge carbonhydrider, der er involveret i dobbeltbindingen.
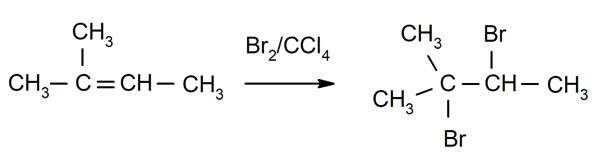
-
Hydrogenering af alkener. Hydrogener tilsættes til de carbonatomer, der er involveret i dobbeltbindingen, til dannelse af den tilsvarende alkan.
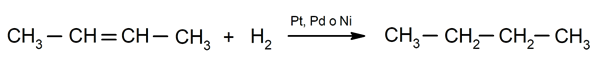
Betydningen af kemiske fænomener
Mange kemiske fænomener opretholde livet af levende ting, såsom fordøjelse hos mennesker og dyr, fotosyntese i planter og respiration i begge.
En anden meget vigtig kemisk proces, især i mikroorganismer, er gæring, som normalt anvendes til fremstilling af mad som oste, yoghurt, vin og øl.
Alle øge og vækst af en levende væsen Det involverer kemiske reaktioner, der finder sted i det, undertiden stimuleret af visse miljøforhold.
Eksempler på kemiske fænomener
Omkring os er der adskillige tilfælde af kemiske fænomener eller processer, der inkluderer dem:
- Træ rådne
- Forbrænding papir
- Modstand mod antibiotika bakterie
- Mælk, der bliver sur
- Desinficering af et sår med alkohol
- Brug af frugtsalt til at bekæmpe halsbrand
- Brænder et lys
- Blodstørkning
- Muskeltræthed efter intens træning
- Død af insekter af insekticider
- Opnåelse af Roquefort-ost
- Opnåelse af cider
- Opnåelse af yoghurt
- Kompostering
- Ensilage
- Opnåelse af bioethanol fra melasse
- Hævede dåser
- Rådne æg
- Rust af en rist
- Indhentning af biodiesel fra palmeolie
Kemiske fænomener i industrien
Visse kemiske fænomener er også nøglen tilindustri. Til at begynde med forbrændingen af kulbrinter (såsom benzin, diesel eller petroleum) producerer Energi at køre maskiner, der håndterer utallige industrielle processer.
På den anden side er stålindustrien, papir, plast, byggematerialer, maling, medicin, produkter til agro osv. er baseret på forskellige kemiske fænomener såsom galvanisering, elektrolyse og mange andre mere.
Generationen af nye energikilder (som biodiesel og bioethanol) er også baseret på denne type fænomen.
Transformationen af energi
I kemiske fænomener er det almindeligt, at der er energitransformation. For eksempel når den kemiske energi indeholdt i bindingerne til et bestemt molekyle omdannes til elektrisk energi eller frigives som varme (dette forekommer i eksoterme fænomener, såsom når saltsyre blandes med zink), er der en transformation af Energi. Det samme sker, når lysenergi fanges og omdannes til kemisk energi.
Nogle kemiske processer kræver varme for at køre og kaldes "endotermiske." Andre kræver tilstedeværelse af katalysatorer eller kofaktorer.

