20 eksempler på syresalte
Miscellanea / / July 04, 2021
I uorganisk kemi salte kaldes forbindelser, der opnås, når a syre dets hydrogenatomer er erstattet af metalliske kationer (skønt nogle gange ikke-metalliske kationer, for eksempel ammoniumkationen, NH4+). I det specifikke tilfælde af syresalte, er syrenens hydrogener delvist substitueret, dvs. mindst et usubstitueret hydrogen er tilbage som en del af saltet. På den måde skelnes de fra neutrale saltehvor hydrogenerne i syren er totalt substituerede.
Det du går ud dannes sædvanligvis gennem reaktionen mellem a syre og en hydroxid (grundlag). I disse reaktioner mister basen normalt sine hydroxylgrupper (-OH), og syren mister dem. atomer hydrogen (H), der danner et neutralt salt; men hvis den pågældende syre konserverer mindst et af dens hydrogenatomer og ændrer reaktionens elektriske ladning, får vi et syresalt eller et hydrogeneret salt.
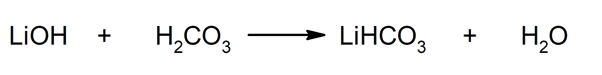
Således opnås f.eks. Lithiumhydrogencarbonat og vand fra reaktionen mellem lithiumhydroxid og kulsyre:
Nomenklatur for syresalte
Syresalte kan navngives i henhold til tre typer mest almindelige nomenklatur:
Eksempler på syresalte
- Natriumbicarbonat (NaHCO3). Også kaldet natriumhydrogencarbonat (IV), det er et hvidt krystallinsk fast stof, opløseligt i vand, som kan findes i naturen i staten mineral eller det kan produceres i laboratoriet. Det er et af de mest kendte syresalte og bruges i vid udstrækning i konfekture, farmakologi eller yoghurtfremstilling.
- Lithiumbicarbonat (LiHCO3). Dette syresalt er blevet brugt som opsamlingsmiddel for CO2 i situationer, hvor sådan gas er uønsket, som i de nordamerikanske "Apollo" -opgaver.
- Kaliumdihydrogenphosphat (KH2PO4). Det er et krystallinsk fast stof, lugtfrit, opløseligt i vand, meget udbredt i forskellige industrier såsom gær af mad, chelateringsmiddel, ernæringsmæssig forstærker og assistent i gæringsprocesserne.
- Natriumbisulfat (NaHSO4). Det er et syresalt dannet ved neutralisering af svovlsyre. Det bruges i vid udstrækning industrielt til raffinering af metaller og rengøringsprodukter. Selvom det er meget giftigt for nogle pighuder, bruges det som tilsætningsstof i foder til kæledyr og til fremstilling af smykker.
- Natriumhydrogensulfid (NaHS). Det er en farlig forbindelse at håndtere, da den er meget ætsende og giftig. Det kan forårsage alvorlige forbrændinger af huden og øjenskader, da det også er brændbart.
- Calciumhydrogenphosphat (CaHPO4). Det bruges som et kosttilskud i korn til kvæg. Det er et fast stof, der er uopløseligt i vand, men som kan krystallisere, når det hydratiseres ved at indtage to molekyler af vand.
- Ammoniumhydrogencarbonat ([NH4] HCO3). Også kendt som "ammoniumhydrogencarbonat", det bruges i fødevareindustrien som gær kemisk, selvom det har ulempen ved at fange ammoniak og give mad en dårlig smag, hvis den bruges i overskydende. Det bruges også i ildslukkere, pigmentfremstilling og til at udvide gummi.
- Baribicarbonateller (Ba [HCO3]2). Det er et syresalt, der ved opvarmning kan vende sin produktionsreaktion og er yderst ustabil, undtagen i opløsning. Det er meget brugt i den keramiske industri.
- Natriumbisulfit (NaHSO3). Dette salt er yderst ustabilt, og i nærvær af ilt stammer det til natriumsulfat (Na2SW4), hvorfor det bruges i fødevareindustrien som et konserveringsmiddel og tørremiddel. Det er et ekstremt reduktionsmiddel og ofte brugt af mennesker, også brugt til at fastgøre farver.
- Calciumcitrat (AC3[C6H5ELLER7]2). Almindeligt kendt som bittert salt, bruges det som et konserveringsmiddel og som et ernæringstilskud, når det er knyttet til aminosyren lysin. Det er et hvidt, lugtfrit, krystallinsk pulver.
- Monocalciumphosphat (Ca [H2PO4]2). Det er et farveløst fast stof, der opnås ved omsætning af calciumhydroxid og fosforsyre, der er meget brugt som hævemiddel eller som gødning i landbrugsarbejde.
- Dicalciumphosphat (CaHPO4). Også kendt som calciummonohydrogenphosphat, det har tre forskellige krystallinske former, der bruges som tilsætningsstof i mad og er til stede i tandpastaer. Derudover er det dannet naturligt i nyresten og i den såkaldte "nyresten".
- Monomagnesiumphosphat (MgH4P2ELLER8). Det er et hvidt, krystallinsk og lugtfrit salt, delvist opløseligt i vand. Det bruges til konservering af mad, som et suremiddel, som en surhedsgrad eller middel til behandling af mel.
- Natriumdiacetat (NaH [C2H3ELLER2]2). Dette salt bruges som smags- og konserveringsmiddel til måltider, hvilket forhindrer eller forsinker udseendet af svampe og mycobakterier, både i vakuumpakede produkter såsom kødprodukter og i melindustrien.
- Calciumbicarbonat (Ca [HCO3]2). Det er et hydrogeneret salt, der stammer fra calciumcarbonat, der findes i mineraler som kalksten, marmor og andre. Denne reaktion involverer tilstedeværelsen af vand og CO2, så det kan forekomme spontant i huler og huler, der er rige på calcium.
- Rubidium syrefluorid (RbHF). Dette salt opnås ved omsætning af flussyre (hydrogen og fluor) og rubidium, et alkalimetal. Resultatet er en giftig og ætsende forbindelse, der skal håndteres med forsigtighed.
- Monoammoniumphosphat ([NH4] H2PO4). Det er et vandopløseligt salt produceret ved reaktion mellem ammoniak og fosforsyre. Det bruges normalt som gødning, da det giver jorden den næringsstoffer af nitrogen og fosfor, der er nødvendigt for plantevækst. Det er også en del af ABC-pulveret i ildslukkere.
- Zinkhydrogenorthoborat (Zn [HBO3]). Det er et salt, der anvendes som et antiseptisk middel og som et additiv til fremstilling af keramik.
- Mononatriumphosphat (NaH2PO4). Det bruges hovedsageligt i laboratorier som en "buffer" eller bufferopløsning, der forhindrer pludselige ændringer i pH-værdien af en opløsning.
- Kaliumhydrogenphthalat (KHP). Også kaldet "kaliumsyrephthalat", det er et fast og stabilt salt i almindelig luft, hvorfor det ofte bruges som en primær standard i målinger af pH. Det er også nyttigt som et buffermiddel i kemiske reaktioner.
Følg med:



