20 eksempler på Alkenes
Miscellanea / / July 04, 2021
Det alkener De er forbindelser indeholdende carbon-carbon dobbeltbindinger. Når disse forbindelser har åbne kædestrukturer, reagerer de på molekylformlen CnH2n (hvor n er antallet af kulstofatomer). Alkener kaldes også olefiner og svarer til gruppen af kulbrinter umættet. De opnås hovedsageligt som en del af olie-krakningsprocessen og ved dehydrogenering af alkaner. For eksempel: ethen, propen, cyclohexen.
De er organiske forbindelser, der kan være kort, mellemlang eller lang kæde; der er også cykliske alkener eller cycloalkener. Ved at have carbon-carbon dobbeltbinding har alkener færre hydrogener end alkaner svarende til det samme antal atomer kulstof.
Hvordan navngives alkener?
For at navngive alkenerne, kulstofkæde der indeholder den største mængde kulstofatomer, og som også indeholder dobbeltbindingen. Hvis denne kæde har flere dobbeltbindinger, navngives de på udkig efter den mindst mulige kombination af positionerne for disse dobbeltbindinger.
Positionen for dobbeltbinding Det er angivet ved at indsætte før suffikset -no det latinske præfiks, der angiver antallet af kulstof, hvor dobbeltbindingen begynder (di (2), tri (3), tetra (4), penta (5), octa (8) osv.). Substituenter (normalt klor, brom, ethyl, methyl osv.) Navngives som præfikser (i begyndelsen af navnet), detaljeret og i alfabetisk rækkefølge navngives de også på udkig efter den mindst mulige kombination af deres positioner i kæde. For eksempel:
1-buten / 1,2-butadien / 5-chlor-1-penten / 4-pentenylchlorid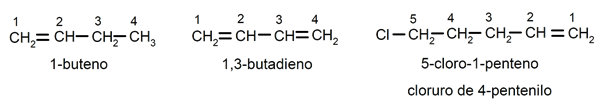
I betragtning af hvor komplekst det kemiske navn er etableret i henhold til IUPAC-kriterierMange naturligt forekommende organiske alkener har smarte navne, ofte relateret til deres naturlige kilde. For eksempel: limonen / 1-methyl-4- (1-methylethenyl) -cyclohexen / geraniol / 3,7-dimethyl-2,6-octadien-1-ol
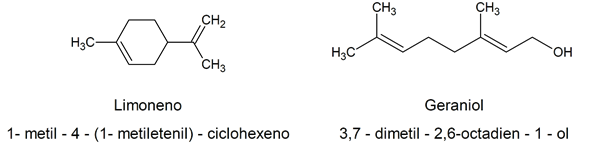
Alkener på op til fire carbonatomer er gasser ved stuetemperatur, dem med 4 til 18 carbonatomer De er væsker og de længste er solid. De opløses i opløsningsmidler organisk som ether eller alkohol og er lidt tættere end de tilsvarende alkaner (dvs. med det samme antal carbonatomer)
Pointen med fusion Y kogende af alkener, som i alkaner, øges jo længere carbonkæden.
På den anden side på grund af spænding genereret af dobbeltbindingen, er afstanden mellem carbonatomer involveret i dobbeltbindingen i alken 1,34 pm (picometre), mens afstanden af enkeltbindingen i den tilsvarende alkan er 1,54 om eftermiddagen.
De præsenterer en kemisk reaktivitet meget højere end alkaner, netop fordi de har de dobbeltbindinger, der har en densitet høj elektronik, og som kan nedbrydes og tillade tilsætning af andre atomer, ofte brint eller halogener. De kan også opleve oxidation og polymerisering.
Alkener er normalt til stede cis-trans isomerisme eller stereoisomerisme, da carbonatomer forbundet med dobbeltbindingen ikke kan rotere, og dette får substituenterne til at være placeret på samme side af dobbeltbindingen eller på modsatte sider. For eksempel: trans-2-buten / cis-2-buten
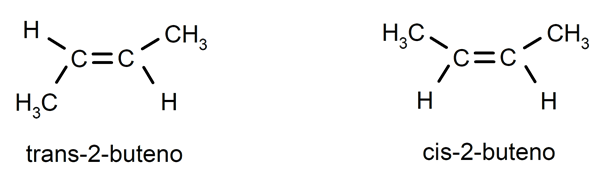
Alkener med to dobbeltbindinger kaldes diener, og dem med mere end to dobbeltbindinger kaldes generelt polyener.
I planteverdenen er alkener ret rigelige og har fysiologiske roller meget vigtig, såsom regulering af frugtmodningsprocessen eller filtrering af visse solstråler.
Den kemiske struktur af organiske alkener er normalt ret kompleks og inkluderer carbonkæder og ringe. Nogle frugter (såsom gulerødder eller tomater) og nogle krebsdyr (som krabber) producerer betydelige mængder beta-caroten, en vigtig alken, der er en forløber for vitamin A.
Eksempler på alkener
- ethene
- 2-methylpropen
- propen
- 2,3-butadien
- myrcen
- limonen
- geraniol
- lycopen
- lanosterol
- mentofuran
- tetrafluorethylen
- 1,3,5,7-cyclooctatetraene
- 5-brom-3-methyl-3-hexen
- 3,5-diethyl-4-propyl-2,5-dimethyl-2-hepten
- 7,7,8-trimethyl-3,5-nonadien
- 3,3-diethyl-1,4-hexadien
- cyclohexen
- 1-chlor-2-methylprop-1-en
- 3-brom-5-methyl-cyclopenten
- 1-methyl-cyclohexen
Diagrammer over de kemiske forbindelser af disse alkener:





