Definition af molekylær geometri
Miscellanea / / January 11, 2022
Begrebsmæssig definition
Det er strukturen af et molekyle, der bestemmer det tredimensionelle arrangement af de atomer, der udgør det i rummet.

Kemisk ingeniør
Molekylære geometrier er i øjeblikket defineret baseret på Teori af Repulsion of Electronic Pairs of the Valencia Layer (TRPECV). Denne teori gør det muligt at forudsige adfærden kemisk af stoffer (specifikt kovalente) og hjælper med at forstå fordeling elektronik, hvilket fører til geometri af molekyle. Dette giver os igen mulighed for at forstå mange af de egenskaber, som stoffer erhverver.
Denne teori er baseret på en række grundlæggende søjler, som vi vil gennemgå og derefter forsøge at forstå deres Ansøgning øve sig. For det første tænkes bundne og ubundne (valens) elektroner som et hav af elektroner, der vha. har den samme type ladning, de frastøder hinanden, så de vil altid være placeret så langt væk fra det centrale atom i molekyle.
For det andet danner dette "hav" af elektroner eller "elektroniske sky" områder med høj elektrontæthed, der er opbygget i bindinger, hvor elektronerne er fælles eller i par af elektroner, der ikke er fælles. Til gengæld kan de bindinger, der dannes, være enkelt, dobbelt eller endda tredobbelt.
Endelig for beslutte molekylær geometri, er det meget nyttigt at have Lewis-strukturen, hvor mængden af elektrontætheder omkring det centrale atom vil blive talt, og dette vil give tegn fra navnet på dets geometri og den form, som molekylet tager tredimensionelt.
Det skal bemærkes, at disse tætheder vil blive placeret så langt fra hinanden som muligt, for at vedtage den mest stabile struktur, og hvor der er mindre frastødning. Sådan identificeres først den elektroniske geometri og derefter den molekylære geometri.
Seks niveauer af tæthed
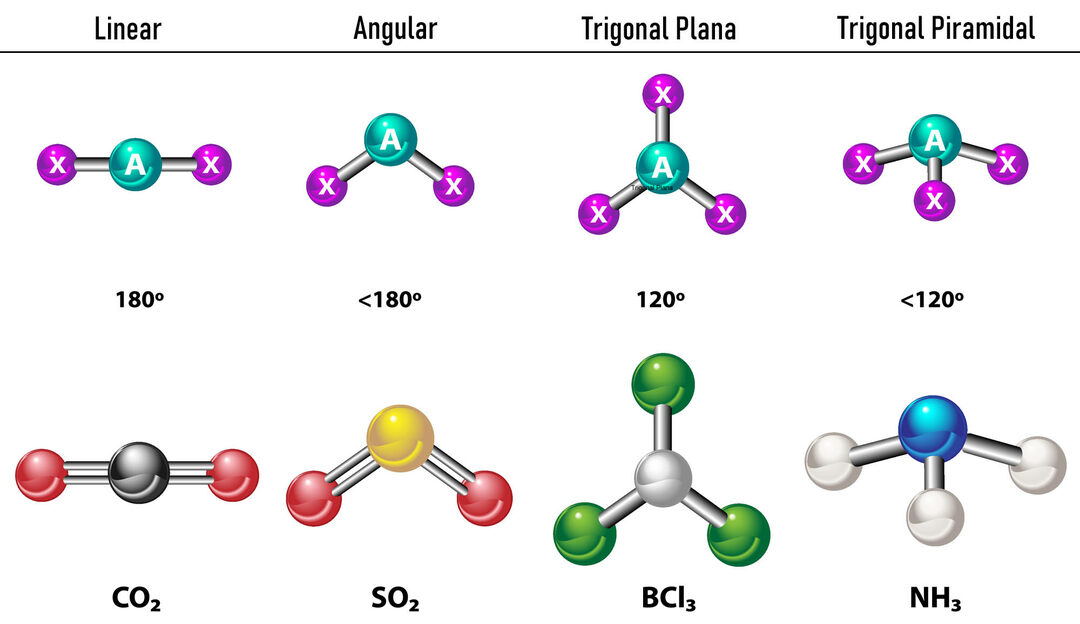
I tilfælde af at der er to elektrontætheder omkring det centrale atom, vil bindingerne være placeret så langt fra hinanden mellem dem, det vil sige 180º fra hinanden, og derfor er deres elektroniske geometri lineær og molekylært er den også lineær.
I tilfælde af, at der er tre elektrontætheder omkring det centrale atom, er der to muligheder: tre bindinger eller to bindinger og et ubundet par. Hvis der er tre bindinger, er den elektroniske geometri Trigonal flad, med 120º vinkler mellem bindinger og molekylær geometri tager samme navn. Nu, hvis der er et ikke-bundet par, frastøder de hinanden med mere intensitet at bundne ladninger derfor har en tendens til at komprimere bindingsvinkler. Vinklen mellem det frie par og hver binding er 120º, og den elektroniske geometri er Trigonal Plane, mens den molekylære geometri er Angular.
I tilfælde af, at der er fire elektrontætheder omkring det centrale atom, er den elektroniske geometri tetraedrisk. Hvis alle fire elektronpar er bundet, falder deres molekylære geometri i navn sammen med deres elektroniske geometri, og bindingsvinklen er 109,5º. Nu, hvis et af parrene er frit, bliver bindingsvinklen mindre (107º), og den molekylære geometri er type Trigonal pyramide. Endelig, hvis to er frie par og to er bundet, er bindingsvinklen 104,5º, mens den molekylære geometri kaldes Kantet.
Når elektrontæthederne omkring det centrale atom er fem, kaldes det a Trigonal bipyramide dens elektroniske geometri. Hvis alle belastningerne er forbundet, er der vinkler på 120ºC mellem de ækvatorialt placerede led og 90º mellem de aksiale med de ækvatoriale. Nu kaldes molekylær geometri også Trigonal Bipyramid, mens den molekylære geometri med fire forbundne par og et frit par er forvrænget og danner den velkendte "rocker”, Der er navnet, den får Forvrænget tetraeder. Hvorimod, hvis to af de fem elektronpar er frie og tre af dem er bundet, har den en "T"-formet geometri, og dens navn skyldes netop dens struktur. Endelig, hvis det er omvendt, tre frie par og to bundne ladninger, er den molekylære geometri lineær.
Endelig er der seks elektrontætheder omkring det centrale atom, og der dannes et oktaeder, deraf navnet i elektronisk geometri. På samme måde er den molekylære geometri navngivet, hvis alle dens par er forbundet. Hvis du har fem forbundne par og et frit par, er den molekylære geometri Square Base Pyramid. Hvis du har fire bundne par og to frie par, er den molekylære geometri Firkantet flad.
Figur: Sød natur
Emner i molekylær geometri