Begreb i definition ABC
Miscellanea / / April 22, 2022
definition af begrebet
Azeotroper er blandinger af kemiske forbindelser, med en defineret sammensætning, der koger ved bestemte temperaturer. Det grundlæggende kendetegn er, at blandingen opfører sig, som om den var et enkelt rent stof, bevarer dets egenskaber og giver nem håndtering.

Kemisk ingeniør
Blandingen kan gives af to eller flere komponenter og dens sammensætning det er det samme både i væskefasen og i gasfasen, dette skaber ligheder med rene stoffer. Heraf kan man let udlede, at denne blanding ikke kan adskilles i dens komponenter ved processer som f.eks fraktionerede destillationer, da det, som nævnt ovenfor, vil bevare sine proportioner og opføre sig som om det var en enkelt komponent.
Et andet kendetegn er, at kogepunktet for denne blanding kan være højere, lavere eller endda lig med kogepunktet for en af dens komponenter. Når azeotropen koger ved a temperatur af maksimal kogning, er det kendt som maksimum azeotrop, og når det gør det ved den lavest mulige temperatur, er det kendt som minimum azeotrop. Det betyder, at den minimale azeotrop har et lavere kogepunkt end dens rene komponenter og omvendt med den maksimale azeotrop. For eksempel i blandingen methanol - benzen er azeotropen minimum (0,61 benzen - 0,39 methanol i fraktioner molær), hvis kogepunkt er 58 °C, i en tank, hvor kogepunktet for benzen er 80 °C og for methanol 65°C
Minimum og maksimum azeotroper
Nu... hvor kommer en azeotrop fra? Når der er en afvigelse fra Lov Raoult, det vil sige, at damptrykket af den azeotropiske blanding ikke er direkte relateret til dens molære fraktion, det er når begrebet azeotropisk blanding opstår. Disse afvigelser opstår, når komponenterne væsentligt tiltrækker eller frastøder hinanden, det vil sige, at de intermolekylære kræfter er meget forskellige i forskellige forbindelser.
Når afvigelsen er positiv, har vi den mindste azeotrop, mens hvis afvigelsen er negativ, har vi den maksimale azeotrop. For bedre at forstå dette koncept, lad os se på nogle grafikker:
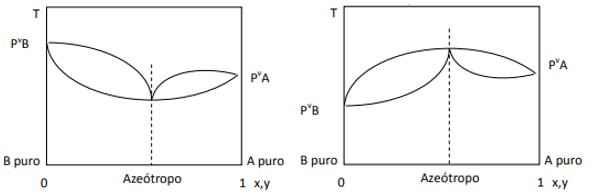
Her observerer vi, at hvis blandingen var ideel, ifølge Raoults lov, skulle damptrykket af de rene komponenter forbindes med en ret linje, da godt, der er en afvigelse fra den lov, der forårsager dannelsen af minimum og maksimum azeotroper, afhængigt af om der er større eller mindre affinitet mellem komponenter. Når afvigelsen til Raoults lov er negativ, som på figuren til venstre, er den minimum kl. diagram af tryk, men et maksimum i temperaturdiagrammet (derfor azeotrop af maksimum). På den anden side, hvis afvigelsen er positiv til Raoults lov, vil den være et maksimum i trykket vs. sammensætning, men et minimum i diagrammet over temperatur vs. sammensætning (her har vi en minimum azeotrop). Forveksle ikke diagrammer tryk vs. sammensætning og temperatur vs. sammensætning.
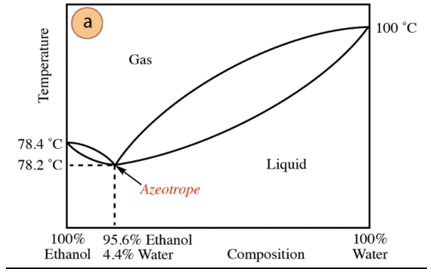
I tilfælde af ethanol-vand-blandingen er der en minimum azeotrop, hvis sammensætning er 95,6% ethanol og 4,4% vand. Kogetemperaturen for den azeotropiske blanding er 78,2 °C lavere end den for de rene komponenter. Så antag at destillere en vand-ethanolblanding med et højt vandindhold (tæt på 100%). Det vil ikke være muligt at opnå ren alkohol, da der vil opnås større fraktioner i hvert destillationstrin. ethanol, men aldrig når 100 %, vil det gradvist nærme sig sammensætningen af den azeotrope blanding (det laveste punkt under). Derfor har det ligesom vand en tendens til at danne minimumsazeotroper med organiske forbindelser (i betragtning af typen af intermolekylære kræfter, der interagerer), er det nødvendigt at fjerne vandet fra blandingen for at opnå den rene forbindelse. Eller, når først azeotropen er opnået, metoder til udvinding ekstra vand.
Baseret på ovenstående er det ikke tilfældigt at finde alkohol (i supermarkedet og apotek) på 95 %, er det billigste produkt, der kan fås. For at opnå ren alkohol er det nødvendigt at "bryde" azeotropen med teknik yderligere, såsom brugen af tørremidler eller azeotrope destillationer. Azeotropisk destillation består i at tilsætte en ekstra komponent til blandingen, der virker ved medbringelse og vha. interaktion med en hvilken som helst af komponenterne i blandingen (højere affinitet) kan fjernes fra blandingen.
Emner i Azeotroperne


