30 Eksempler på alkoholer
Eksempler / / November 06, 2023
Det alkoholer er organiske kemiske forbindelser som i deres struktur indeholder den funktionelle hydroxylgruppe (-OH) bundet til et kulstof (- C). Gruppen (- C – OH) kaldes "carbinol". Nogle eksempler på alkoholer er: methanol, ethanol og 1-propanol.
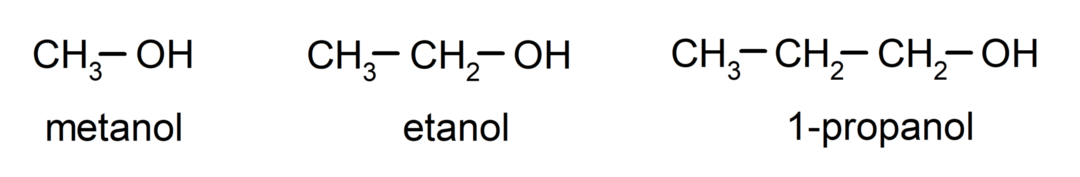
Alkoholer er kemiske forbindelser med forskellig anvendelse i hverdagen, da de har antibakterielle og antiseptiske egenskaber. På den anden side kan de være farlige for menneskers sundhed, når de indtages ukontrolleret.
Ligeledes kan ikke alle alkoholer indtages af mennesker.
- Se også: Aminer og ketoner
Typer af alkoholer
Afhængigt af antallet af carbonatomer, som carbonatomet, der har hydroxylgruppen knyttet til, er knyttet til, kan en alkohol være:
- Primær alkohol. Kulstofatomet, der har hydroxylgruppen knyttet, er også bundet til et enkelt kulstofatom. For eksempel:
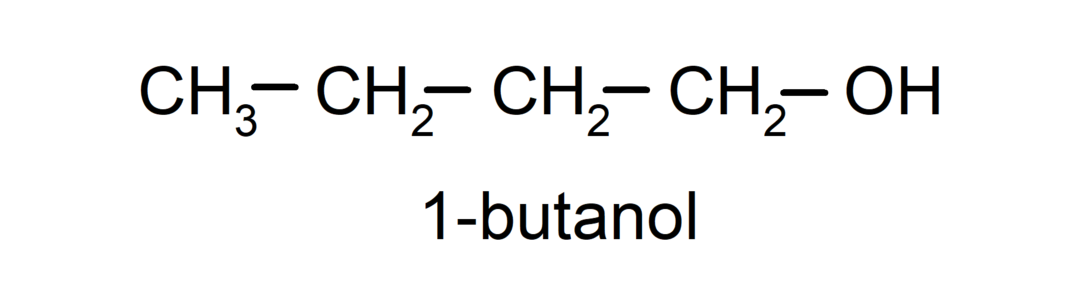
- Sekundær alkohol. Kulstofatomet, der har hydroxylgruppen knyttet, er også bundet til to andre kulstofatomer. For eksempel:
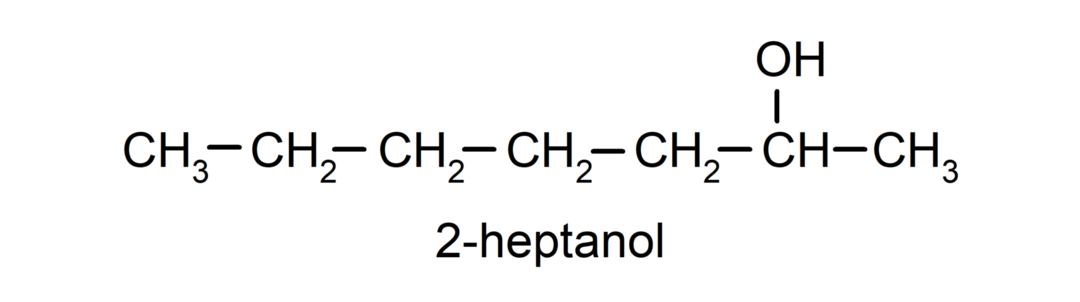
- Tertiær alkohol. Kulstofatomet, der har hydroxylgruppen knyttet, er også knyttet til tre kulstofatomer. For eksempel:
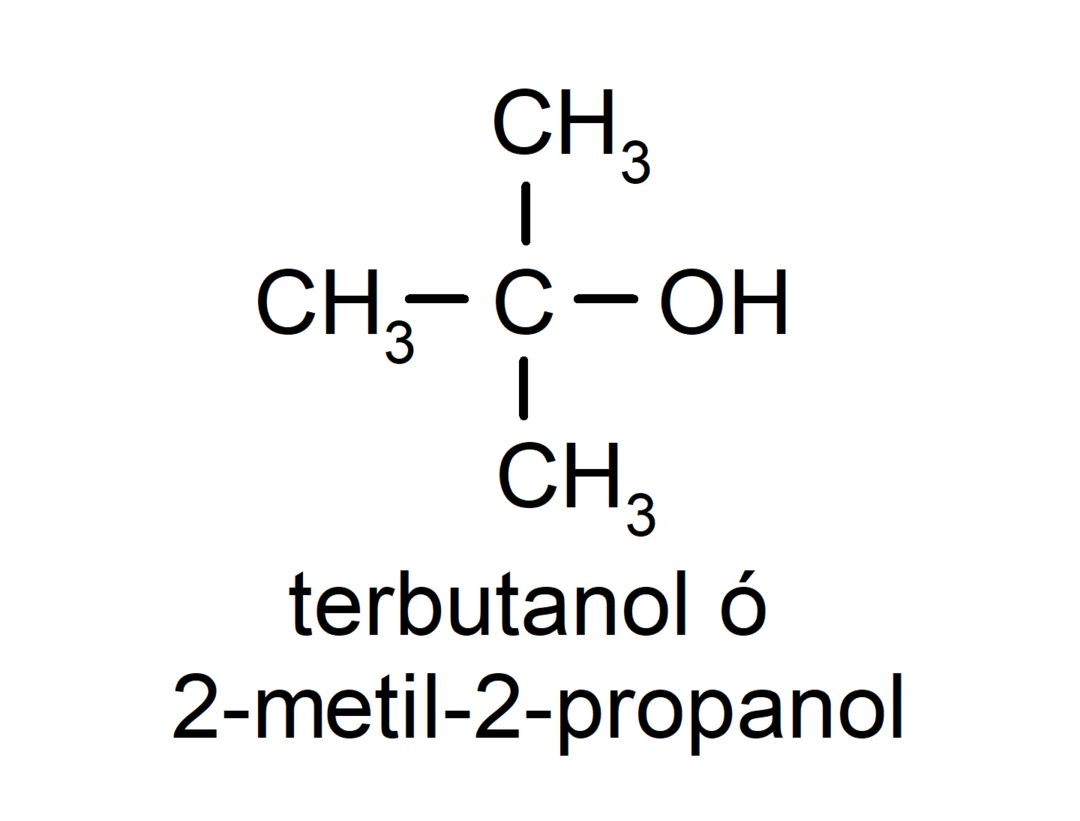
Afhængigt af antallet af hydroxylgrupper, den har, kan en alkohol være:
- Diol. Det har to hydroxylgrupper i sin struktur. For eksempel:
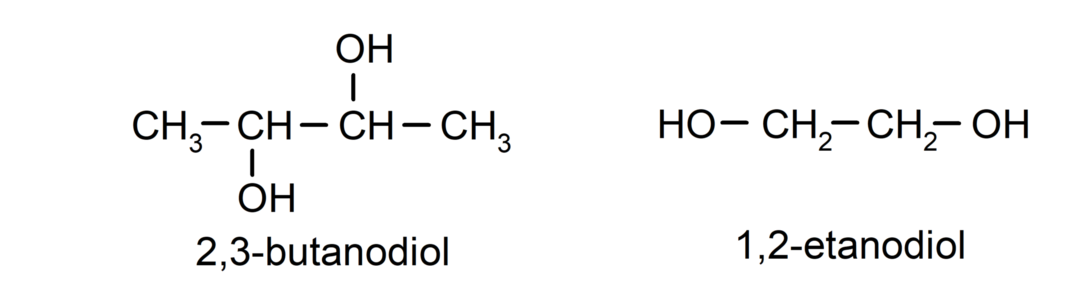
- Triol. Det har tre hydroxylgrupper i sin struktur. For eksempel:
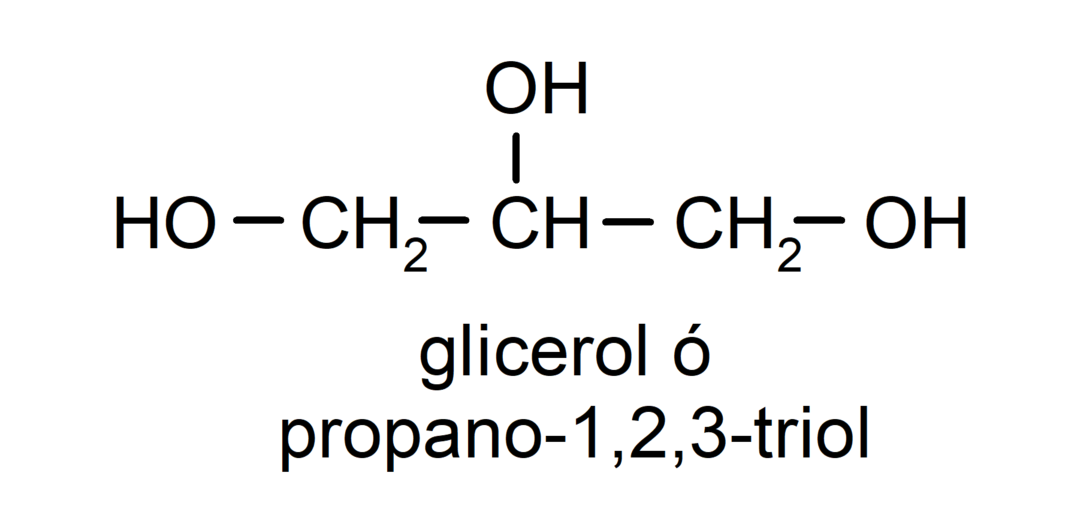
- Polyalkohol. Det har mange hydroxylgrupper i sin struktur. For eksempel:
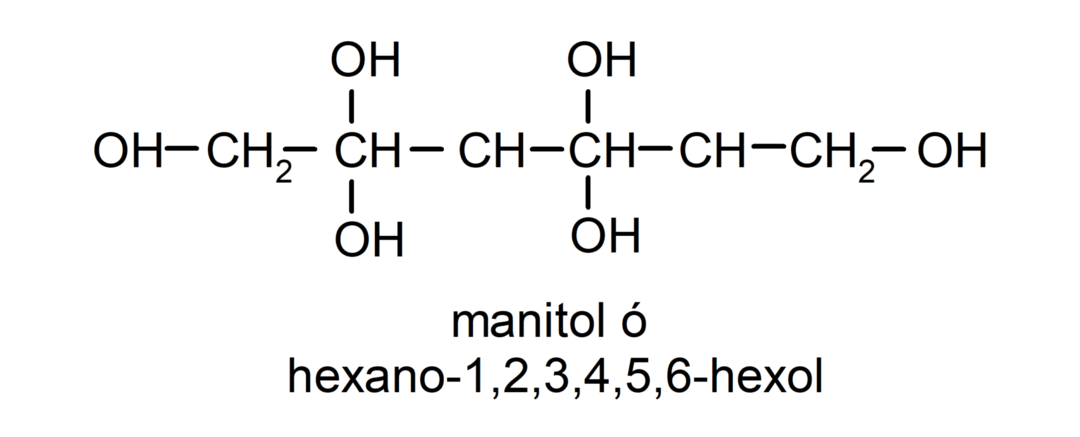
Fysiske egenskaber af alkoholer
Nogle af de fysiske egenskaber ved alkoholer er:
- Kogepunkt. Kogepunktet i alkoholer er ret højt på grund af tilstedeværelsen af hydroxylgruppen, som tillader dannelsen af hydrogenbindinger. Ydermere, jo flere hydroxylfunktionelle grupper er til stede i carbonkæden, jo højere er Kogepunkt af alkoholer.
- Polaritet. Alkoholer er ret polære forbindelser.
- Opløselighed. Lavmolekylære alkoholer er opløselige i vand. På den anden side, jo større kulstofkæden af alkoholer er, jo lavere er deres opløselighed i vand. Derudover, jo flere hydroxylgrupper alkoholer har, jo større er deres opløselighed i vand.
- Aggregeringstilstand. De fleste alkoholer er flydende ved stuetemperatur (25ºC) og har karakteristiske lugte.
Kemiske egenskaber af alkoholer
Nogle af de kemiske egenskaber ved alkoholer er:
- Alkoholer opfører sig som syrer og baser.. Deres adfærd som syrer kan ses i reaktioner med aktive metaller for at frigive brintgas og danne alkoxider.

Deres adfærd som baser kan ses i reaktioner såsom reaktionen af methanol med hydrogenbromid til dannelse af methyloxoniumbromid.
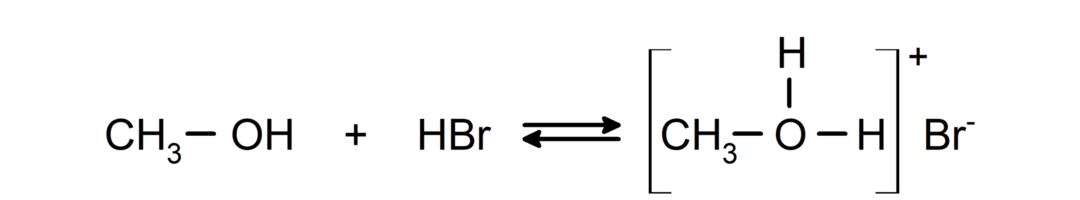
- Alkoholer gennemgår halogeneringsreaktioner. De reagerer med hydrogenhalogenider for at danne alkylhalogenider.
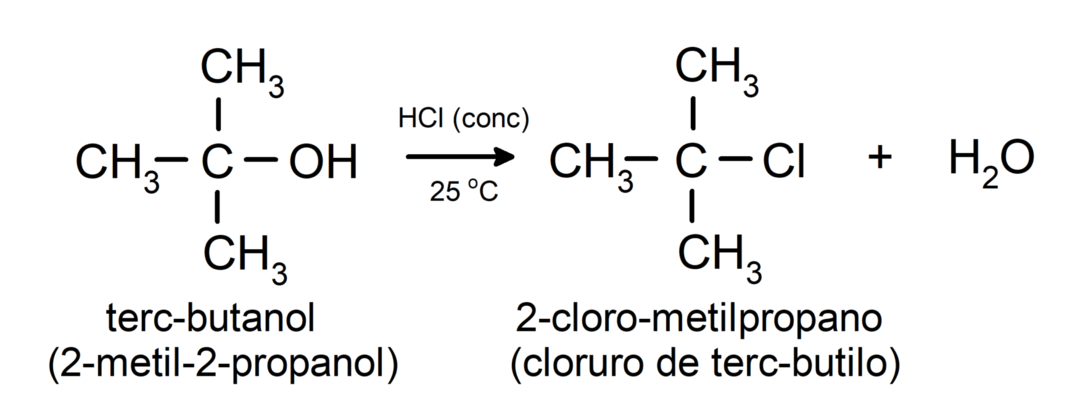
-
Alkoholer gennemgår oxidationsreaktioner når de reagerer med visse oxiderende forbindelser. Produkterne af oxidationsreaktioner afhænger af typen af alkohol, der reagerer, det vil sige om den er primær, sekundær eller tertiær.
Oxidation af primær alkohol til dannelse af aldehyd eller carboxylsyre.
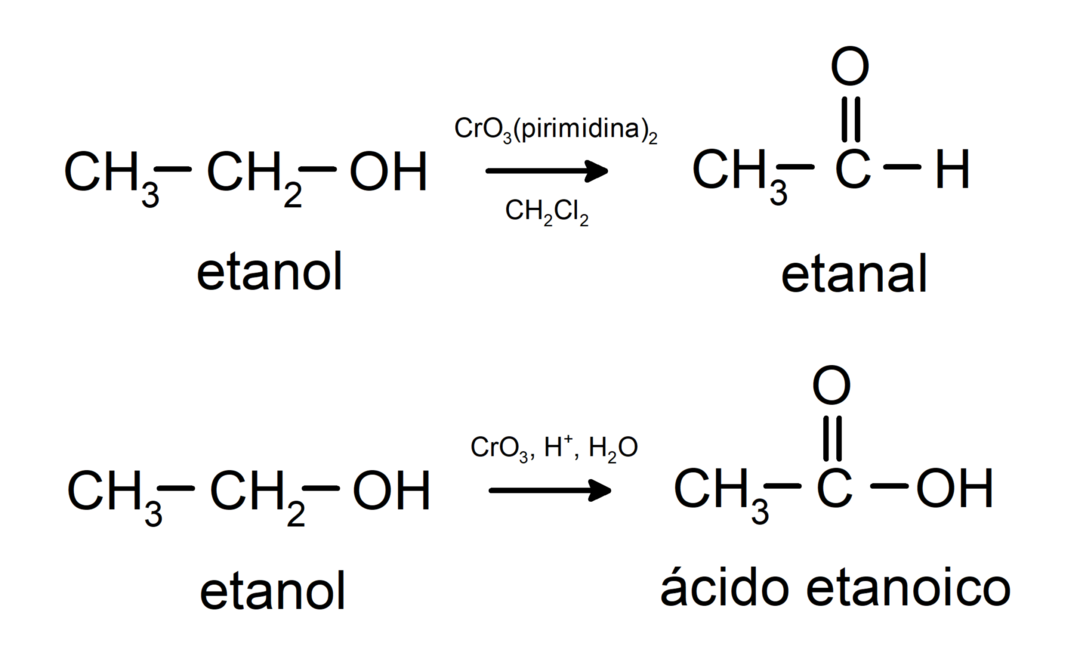
Oxidation af sekundær alkohol til dannelse af keton.
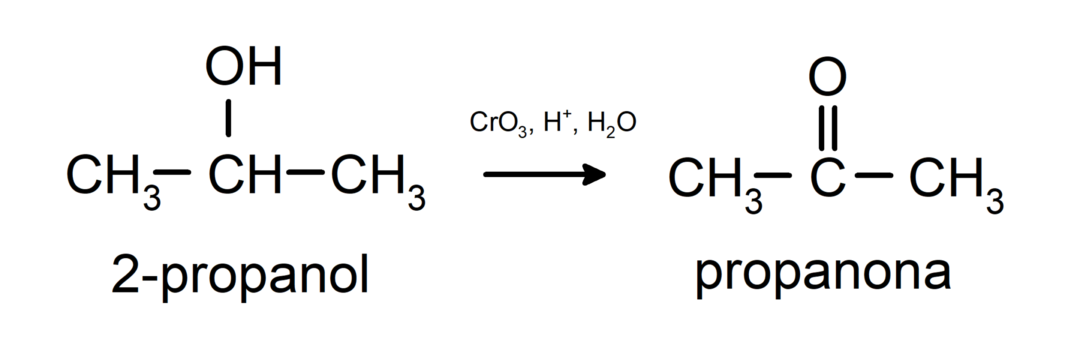
Tertiære alkoholer oxiderer ikke med almindelige oxidanter. Med meget stærke oxidationsmidler kan de omdannes til alkener, som derefter kan oxideres.
Alkoholer, der har to hydroxylgrupper placeret på tilstødende carbonatomer, oxideres med blytetraacetat for at danne to ketoner.
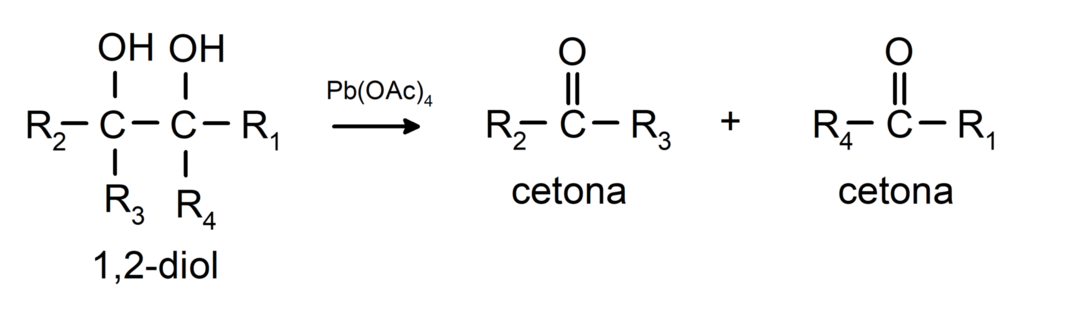
- Alkoholer gennemgår dehydrogeneringsreaktioner. Disse reaktioner forekommer kun med primære og sekundære alkoholer, som, når de udsættes for høje temperaturer i nærvær af katalysatorer, frigiver hydrogener.
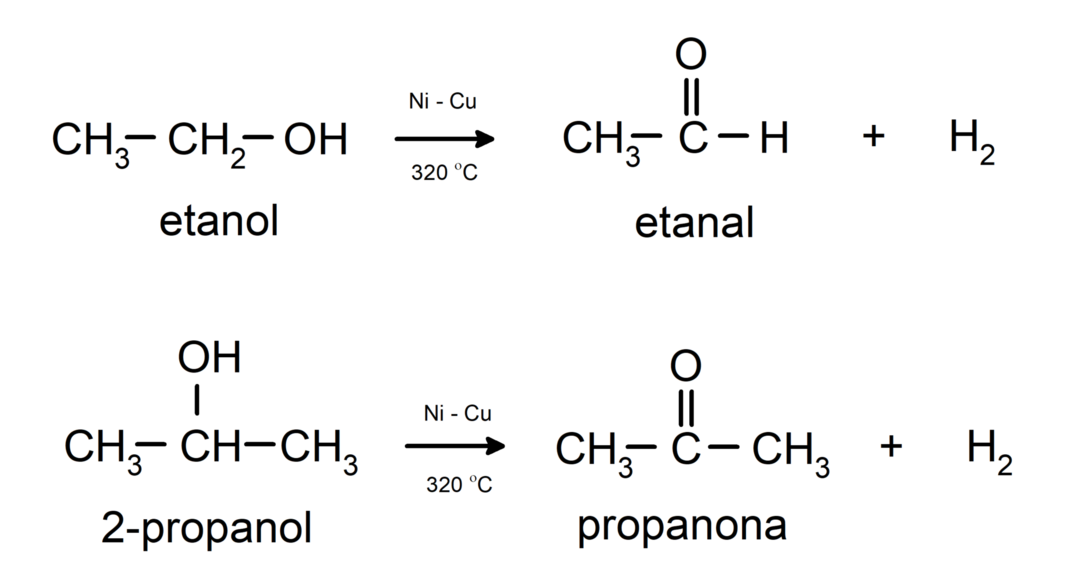
- Alkoholer gennemgår dehydreringsreaktioner. Alkoholer dehydrerer for at danne de tilsvarende alkener. Denne reaktion sker i nærvær af syre- og mellemtemperaturer.
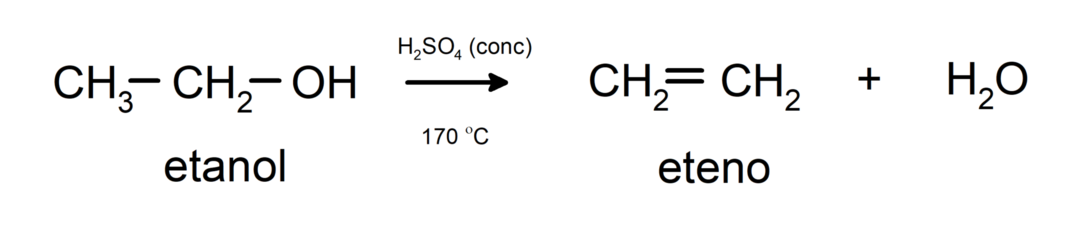
Alkoholnomenklatur
Ifølge nomenklaturen etableret af IUPAC (International Union of Pure and Applied Chemistry), er alkoholer navngivet efter følgende regler:
- Hydroxylgruppens position vælges under hensyntagen til, at den optager det lavest mulige antal i carbonkæden. Hvis strukturen af alkoholen er cyklisk, betragtes 1-positionen på carbonet, der har hydroxylgruppen knyttet, og præfikset cyclo- bruges til at navngive det.
- Navnet på alkoholen skrives ved hjælp af præfikser, der angiver antallet af atomer i kulstofkæden, og derudover placeres endelsen -ol.
- Hvis alkoholens struktur har forgreninger, vælges den længste kæde, der også indeholder hydroxylgruppen, som hovedkulstofkæde.
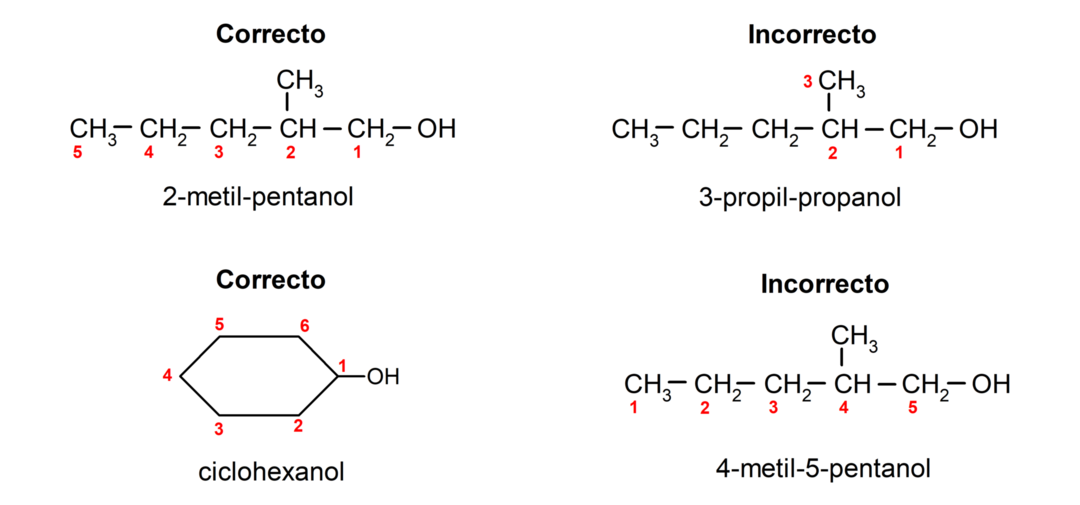
Ifølge traditionel nomenklatur navngives alkoholer ved at skrive ordet "alkohol" og derefter skrive navnet på alkoholen. alkan svarende til kulstofkæden, men i stedet for at bruge -an-enden af alkanen, -yllisk.
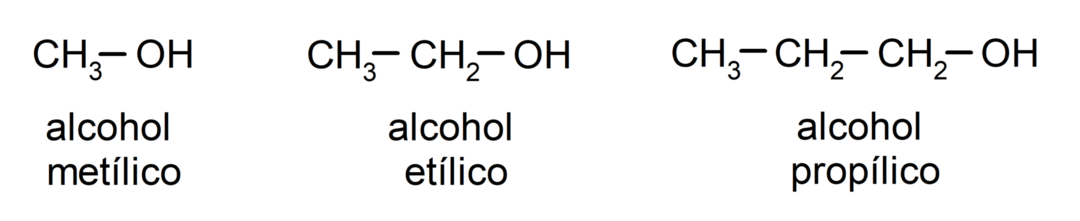
Eksempler på alkoholer
- methanol
- ethanol
- 1-propanol
- 2-propanol
- 1-butanol
- 3-ethylhexan-2-ol
- glycerol
- phenol
- 2-methyl-2-butanol
- 1,2-ethandiol
- 1,5-heptadien-3-ol
- 3-methyl-2-butanol
- benzylmethanol
- 3-pentanol
- 2-methylphenol
- 1,2-dihydroxyphenol
- cycloheaxnol
- 1-phenylethanol


Brug af alkoholer
De mest almindelige anvendelser af alkoholer er:
- De bruges som desinfektionsmidler og antiseptiske midler, da de stopper væksten af nogle mikroorganismer eller ødelægge dem. Ethanol og isopropylalkohol er de mest anvendte til dette formål.
- De bruges i syntesen af forskellige kemiske forbindelser. Methanol bruges for eksempel til at opnå methanal (formaldehyd).
- De bruges til at fremstille frostvæske. Methanol er en af de mest anvendte til dette formål.
- De bruges som opløsningsmidler i den farmaceutiske industri. Ethanol er en af de mest brugte i denne forstand.
- De bruges som opløsningsmidler til lakker, farvestoffer og blæk. Methanol er meget brugt til dette formål.
- De bruges som brændstof, og der er en vigtig tendens til delvist at erstatte brugen af fossile brændstoffer ved brug af bioethanolbrændstof.
- De bruges til at lave harpikser. Phenol bruges i denne forstand.
Farer ved alkoholforbrug
Selvom alkoholforbrug er socialt accepteret i dag, genererer misbrug af dette stof afhængighed og afhængighed.
Ethanol er den alkohol, der findes i alkoholholdige drikkevarer, som, når den indtages i overkant, påvirker kognitive evner, og kan forårsage hjertekarsygdomme, levercirrhose og Kræft.
Ydermere, når graden af alkoholforgiftning er nået, det vil sige en tilstand af fuldskab, hvis dosis af alkohol er for højt, kan der opstå alkoholisk koma, hvilket kan føre til åndedrætslammelse og endda død. død.
Referencer
- T. TIL. Geissman. (1974) "Principles of Organic Chemistry" Anden udgave. Redaktionelt Reverté, S.A. ISBN: 8429171800
- Ahumada-Cortez, J. G., Gámez-Medina, M. E., & Valdez-Montero, C. (2017). Alkoholforbrug som et folkesundhedsproblem. Ra Ximhai, 13(2), 13-24.
- Morrison, R. T., & Boyd, R. N. (1998). Organisk kemi. Pearson uddannelse.
- Weininger, S. J., & Stermitz, F. R. (1988). Organisk kemi. Jeg vendte om.
Følg med:
- Ætanol
- Brændstoffer
- organisk kemi



