Eksempel på metalobligationer
Kemi / / July 04, 2021
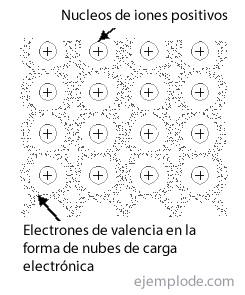
Det Metallisk link er den måde, hvorpå et metals atomer formår at mødes i en krystalstruktur, stabil, ved hjælp af skyer af deres elektronerog uden at være afhængig af eksklusiviteten af ioniske eller kovalente bindinger til at manifestere sig som rene stoffer. Er navngivet Net til gruppen eller arrangementet af metalliske forbindelser.
De fleste metaller krystalliserer i tre typer arrangementer: Body Centered Cubic Networks, Ansigtscentrerede kubiske netværk Y Kompakte sekskantede netværk.
I af krop centrerethvert metalatom er omgivet af 14 naboer og i de andre to tilbage ved 12. Hvis du forsøger at håndtere binding af sådanne strukturer, vil du straks finde problemet med elektronmangel. Således i tilfælde af lithium med en enkelt valenselektron og 14 nære naboer skal det forklares, hvordan dette element er omgivet af et så stort antal atomer, og alligevel genererer det en krystal, der er stabil nok til at have et smeltepunkt på 186 ° C Det samme sker med andre metaller.
Den schweiziske fysiker
Felix bloch I 1928 foreslog han en kvantemekanisk teori for at forklare binding af atomer i metalliske krystaller. Heri Bandteori alle elektroner til stede i et atom ved fuldt fyldte energiniveauer betragtes i det væsentlige placeretdet vil sige bundet til de atomer, som de er knyttet til. På den anden side overvejes valenselektroner i uudfyldte energiniveauer ledig, og de bevæger sig i et potentielt felt, der strækker sig til alle de atomer, der er til stede i krystallen.Det atomorbitaler af disse frie elektroner i et atom kan overlapning med andres oprindelse delokaliserede molekylære orbitaler der producerer en binding mellem alle tilstedeværende atomer, og som er kendt under navnet Ledningsorbitaler.
Det energiniveauer af elektroner i isolerede atomer er diskret og generelt godt adskilt. Men tilstedeværelsen af andre atomer i krystallen påvirker disse niveauer ved at omdanne hvert niveau til et niveau bånd hvis antal er lig med antallet af atomer til stede i den strukturelle totalitet. Hvis dette tal er stort, udgør hvert isolerede niveau praktisk taget a kontinuerligt bånd. Også når rummet mellem de oprindelige niveauer og mellem atomerne i metallet er stort, så bånd, der stammer fra tidlige elektroniske niveauer, er adskilt fra hinanden til huller i energi betydelige. Når niveauer og afstande er små, er båndene det kryds og overlap hver.
Denne teori giver følgende beskrivelse af den elektroniske struktur af et givet metal. EN massivt metal anses for at have elektronbånd adskilt fra hinanden ved huller i energi. Desuden er disse bånd undertiden fuldstændigt fyldte med lokaliserede elektroner, eller de er delvist fyldt med frie elektroner, hvis molekylære orbitaler strækker sig til alle atomer i krystallen.