Eksempel på kemiske baser
Kemi / / July 04, 2021
I generel kemi, Baser er en kategori af kemikalier der udfører flere funktioner:
-Reager med syrer i en neutralisering, der producerer et salt og vand.
-Reguler brintpotentiale, pH, hæve dens værdi, hvis de hældes i midten, hvor en reaktion findes.
-Løb som Kemiske reagenser for et stort antal reaktioner.
Baserne kan være forskellige arter, begge af Uorganisk kemi pr Organisk kemi, Ligesom Hydroxider, det Aminer og Alkoholer, for eksempel.
For at definere basernes opførsel anvendes de tre vigtigste syrebaseteorier: Arrhenius, Brönsted-Lowry og Lewis.
Baserne ifølge Arrhenius
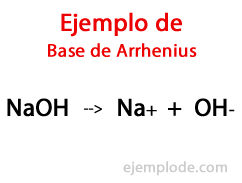
Ifølge den svenske kemiker Svante Arrhenius, Baser er de kemiske stoffer, der tilvejebringe hydroxylioner (OH-) til et reaktionsmedium, især hvis det er en vandig opløsning. Således vil der med de tilgængelige hydroxylioner være en Alkalisk pH, dvs. med en værdi større end 7 og op til 14 afhængigt af hvor meget Base der er til stede på måletidspunktet.
Dette er en af de enkleste og mest praktiske teorier at anvende, da det ikke har komplikationer til at differentiere de stoffer, der deltager i reaktionen. Det er velkendt, hvilket er syren, og hvilket er basen.
Inden for denne teori er der utvivlsomt uorganiske hydroxider, såsom natriumhydroxid (NaOH) og kaliumhydroxid (KOH).
Baserne ifølge Brönsted-Lowry
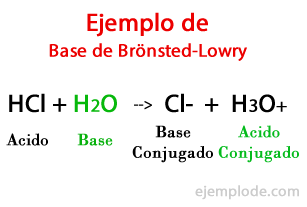
Ifølge teorien formuleret af den danske Johannes Brönsted og briterne Thomas Martin Lowry, en base er en kemisk art i stand til at modtage protonerne, som en anden, syren, vil give under en kemisk reaktion. Protonen er generelt relateret til den positive ladning, der karakteriserer den, så vi kan forbinde den igen med hydrogenioner (H +).
Når udvekslingen sker i den kemiske reaktion, produkterne kaldes: "Konjugeret syrebase" og "Konjugeret basesyre"baseret på de reaktanter, der dannede dem.
For denne teori er Ammoniak (NH3) er den mest repræsentative sag. For Brönsted og Lowry er de stoffer, der er i stand til at tilbageholde hydrogenioner (H +), baser. I dette tilfælde vil ammoniak, ved at opføre sig som en base, erhverve et brint i sin struktur og konsolidere sig selv som en ammoniumion (NH4+) med den overskydende positive ladning af brint. Ammonium er den konjugerede syre af ammoniak.
Aminer, organiske forbindelser afledt af ammoniak (NH3), såsom methylamin (CH3NH2) når de er i opløsning opfører de sig som baser og er i stand til at modtage positive ladninger i deres struktur, enten fra brint eller carbocation.
En carbocation er en organisk ion dannet som en carbonhydridkæde, som i fravær af en negativ ion, hvilken Det kan være hydroxyl (OH-) eller et halogen (Cl-, Br-), det har tendens til at binde til et sted, der kan modtage det, hvilket vil være det Grundlag.
Baserne ifølge Lewis
Den amerikanske videnskabsmand Gilbert Lewis påpegede i sin syrebaseteori, at baserne er de stoffer, der er i stand til at bidrage med deres par frie elektroner til, at en anden fuldender sin oktet.
Denne syre-base teori er et supplement til at bekræfte gyldigheden af dens regel af oktetten, hvor den beskriver, hvordan atomer erhverver stabilitet og når et antal på otte elektroner i deres sidste skal ved hjælp af Bond Kovalent
Hydroxylionen er et godt eksempel på en Lewis Base. Det har et par frie elektroner, hvorpå en hydrogenion, der ikke har elektroner, kan nå. Der dannes et vandmolekyle. Således dannes oktetten til molekylets ilt, og hydrogenerne, som er mindre atomer, vil have deres par elektroner, der gør dem stabile.

Anvendelse af vigtige baser
Det Natriumhydroxid NaOH Det bruges generelt i vandig opløsning til at rense størknet fedt i husholdnings- og industriovne og opløse det effektivt. Det bruges også i koncentreret opløsning, når uforudsete spild af et surt stof forekommer for at neutralisere det.
Det Magnesiumhydroxid Mg (OH)2 Det bruges i en opløsning kaldet "Milk of Magnesia", til at løse halsbrand, neutralisere det. Det sælges på apoteker.
Det Kaliumhydroxid KOH Det bruges som et reagens til forsæbningsprocesser og omdanner fedt til sæbe.
Det Ammoniak NH3 Det bruges i gasform som et industrielt kølemiddel, især i isproducenter. Det er meget farligt at bruge, da indånding af en koncentration på 5 milligram pr. Liter i luften kan være dødelig.
Eksempler på kemiske baser
Vand H2ELLER
Ammoniak NH3
Natriumhydroxid NaOH
Kaliumhydroxid KOH
Magnesiumhydroxid Mg (OH)2
Calciumhydroxid Ca (OH)2
Aluminiumhydroxid Al (OH)3
Ammoniumhydroxid NH4Åh
Ferrohydroxid Fe (OH)2
Jernhydroxid Fe (OH)3
Hydroxylion (OH-)
Chloridion (Cl-)
Bromidion (Br-)

