Kendetegn ved halogener
Kemi / / July 04, 2021
Halogener er de kemiske grundstoffer, der er placeret i gruppe VIIA eller gruppe 17 i det periodiske system. Det består af grundstofferne fluor, klor, brom, iod og astat.
Navnet halogen kommer fra græsk og betyder "producent af salte", da disse grundstoffer danner salte med natrium svarende til almindeligt salt.
Almindelige egenskaber ved halogener:
De er monovalente elementer, dvs. de har kun et valensnummer. I halogener er valensen -1.
De har en affinitet for hydrogen og danner de såkaldte hydracider.
De har ringe affinitet for ilt, så de danner ikke oxider, men ved meget høje temperaturer.
De kombineres med metaller for at danne halogensalte.
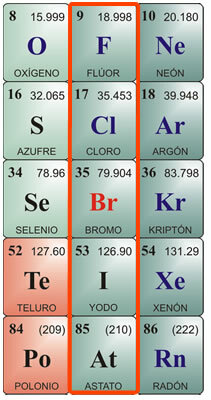
Individuelle egenskaber ved halogener:
Fluoregenskaber:
Kemisk symbol F. Atomnummer 9, atomvægt 19. Fluor i ren tilstand er en gul gas med et smeltepunkt på -223 ° C og et kogepunkt på -187 ° C. Det findes ikke frit i naturen, så det skal isoleres. Det blev først isoleret i 1886. Dens fysiske egenskaber er: Grønlig gul gas, Meget ætsende og irriterende, med en skarp lugt, giftig for mennesker og dyr. Det er vanskeligt at flydende. Kemiske egenskaber: Det kombineres med brint, selv ved meget lave temperaturer med en eksoterm reaktion. Det kombineres med metaller og danner salte. Det nedbrydes saltsyre, der producerer klor, og nedbryder vand og frigiver ilt. På grund af dets affinitet for brint tager det det fra organiske stoffer og forkulgør dem. En af dens vigtigste forbindelser er flussyre, som kun kan opbevares i platin- eller voksbeholdere, da den angriber silica i glas. Det er meget flygtigt og meget ætsende. Når det kombineres med metaller, producerer det fluorider.
Kloregenskaber:
Kemisk symbol Cl. Atomnummer 17, atomvægt 35,5. Smeltepunkt - 102 ° C, kogepunkt -37 ° C. Klor blev opdaget i 1774 og isoleret i 1811. Fysiske egenskaber: Det er en grønlig gul gas, som ikke findes fri i naturen, da den generelt findes kombineret i salte. Det har en kvælende og giftig lugt. Kemiske egenskaber: Klor er meget beslægtet med brint og kombineres i en exoterm reaktion for at producere saltsyre. Saltsyre, også kaldet muriatsyre eller fuming salt, var kendt siden det gamle Rom. Det blev fundet i gasform i vulkaner og opløst i vandet i nogle floder nær vulkanerne. Det er meget ætsende for huden og giftigt, hvis det indtages. Det produceres af maven til fordøjelse. Andre vigtige klorforbindelser er hypochloritter, især natriumhypochlorit, som, når de opløses i vand, bruges som vandblegemiddel, desinfektionsmiddel og steriliseringsmiddel. Neutraliserer syrer.
Brom egenskaber:
Kemisk symbol Br. Atomnummer 35, atomvægt 79.9. Smeltepunkt -7,3 ° C, kogepunkt 58,8 ° C. Det findes ikke frit i naturen, men kombineret med metaller til dannelse af bromider. Det isoleres ved elektrolyse. Fysiske egenskaber: Det er en mørkerød væske med en irriterende lugt. afgiver ved stuetemperatur en irriterende tæt orange-rød damp, der forårsager hoste og rive Det er giftigt. Det opløses i ether eller chloroform og opløses næppe i vand. Kemiske egenskaber: Brom angriber organisk materiale; i levende væsener korroderer det huden og forårsager sår, der er vanskelige at helbrede. Dens vigtigste anvendelse er kombineret med metaller, der danner bromider, der anvendes til industriel anvendelse, såsom sølvbromid, der tidligere blev brugt til fotografering. De bruges også i lave koncentrationer som et antiseptisk middel. Kombineret med brint resulterer det i brombrintesyre, en farveløs gas med en skarp lugt og smag, der hovedsagelig bruges til at angribe metaller og opnå bromider.
Funktioner af Jod:
Kemisk symbol I. Atomnummer 53, atomvægt 126,9. Smeltepunkt 113 ° C; kogepunkt 184 ° C. Det eksisterer ikke frit i naturen. Det findes som iodider i tangbede og som en del af mineralerne i nogle fødevarer, såsom brøndkarse, torskolie og skaldyr. Fysiske egenskaber: Jod er en fast, krystallinsk krop, sortgrå i farve, med en metallisk glans med en stærk og ubehagelig lugt. Det er dårligt opløseligt i vand og meget opløseligt i alkohol. Kemiske egenskaber: Det kombineres med metaller, der danner iodider; også med metalloider, såsom svovl og fosfor. Det har en højere affinitet for ilt end de andre halogener. Når det kombineres med ammoniak, producerer det kvælstofiodid, som er en eksplosiv gas. Kombineret med brint producerer den hydroiodsyre, en farveløs gas med en skarp lugt og smag, der ryger i nærvær af luft. Det opløses i vand og nedbrydes under påvirkning af lys og varme. Hvis syremolekylet indeholder ilt, dannes ioinsyre, som er et krystallinsk fast stof med oxiderende egenskaber. Jod bruges i alkoholisk opløsning som et desinfektionsmiddel og antiseptisk middel.
Funktioner af Astatus:
Ved symbol. Atomnummer 85, atomvægt 210. Det eksisterer ikke frit i naturen. Smeltepunkt 254 ° C; kogepunkt 962 ° C. Astatin blev først syntetiseret i 1940'erne, da det er et element, der frigøres fra nedbrydningen af vismutatomer af alfastråler. Det er et radioaktivt element med en meget kort levetid; den isotop, der varer længst, er At210 med en maksimal levetid på ca. 8 timer. Dens kemiske egenskaber anses for at være meget lig dem af jod; fysisk kunne det have et udseende og egenskaber, der mere ligner metaller. På trods af at det er et radioaktivt element, udgør det ikke en sundhedsfare, da det normalt ikke findes i naturen. Det har kun få anvendelser i laboratoriet til mærkning af atomer i studiet af subatomært materiale.