Eksempel på organisk kemi
Kemi / / July 04, 2021
Det Organisk kemi Det er den del af generel kemi, der har ansvaret for undersøgelsen og den funktionelle klassificering af kemiske forbindelser, hvis strukturelle element er Kulstof, til stede i overflod i levende stof; Dette skaber et meget differentieret univers af uorganisk kemi, dedikeret til kemiske forbindelser klassificeret som mineraler.
Kulstofatomet har fire elektroner i den sidste skal af sin elektroniske konfiguration. Denne egenskab sammen med dets atomare radius gør det muligt at forbinde den med kovalente bindinger til andre atomer af det samme element i mange kæder, der danner en stor mangfoldighed af kemiske forbindelser stabil.
Du kan tjekke Kovalente bindinger.
Sådanne kemiske forbindelser, ud over de carbonatomer, der giver dem deres oprindelige struktur, indeholder hydrogenatomer som det vigtigste supplement til kulstofvalensen. Derudover er der i denne mangfoldighed af forbindelser dem, der involverer iltatomer, Kvælstof, halogener, svovl og endda fosfor, jord- og jordalkalimetaller og metaller af overgang. Afhængigt af hvem der er involveret i molekylet, vil det være de fysiske og kemiske egenskaber af det endelige stof.
Det organiske forbindelser er til stede i hele levende stof; fremme og opretholde alle biologiske funktioneri modsætning til uorganiske eller mineralske stoffer, som er blevet brugt af mennesker til kommercielle formål, til eksperimenter eller til at udføre visse indenlandske opgaver.
Historie af organisk kemi
Før 1828 skelnes der allerede mellem organisk kemi og uorganisk kemi. Organisk stof var forbundet med en skabelse gennem en "vital kraft"og til det uorganiske med det ikke-levende, med mineralet. På baggrund af disse forestillinger kunne man ikke forvente at få organiske forbindelser fra uorganiske materialer i laboratoriet.
Imidlertid, i 1828 Friedrich Wöhler (1800-1882) lykkedes at fremstille et organisk stof, Urea CO (NH2)2, et vigtigt produkt af animalsk stofskifte fra uorganiske forbindelser. Behandling Bly Cyanat Pb (CNO)2 med Ammoniak NH3 at få Ammoniumcyanat NH4CNO; Denne forbindelse blev faktisk dannet, men da opløsningen blev kogt for at krystallisere ammoniumcyanatet, blev den omdannet til urinstof.
Denne kemiske ændring er et eksempel på Intern omgruppering, hvor antallet eller klassen af atomer i molekylet ikke ændres, men kun deres rækkefølge inden for det. Disse typer af transformationer er meget almindelige i organisk kemi.
Wöhlers opdagelse indledte senere opgivelse af livskraftsteorien kasseres fuldstændigt ved at blive fulgt af fremstillingen af mange andre organiske forbindelser i laboratorium. På trods af dette eksisterer kvalifikationerne for uorganisk og organisk, da uorganiske forbindelser er relateret til mineralprodukter og organiske forbindelser, der faktisk er forbindelser af carbon og hydrogen og deres derivater, er af den type, der produceres af levende organismer.
Selvom lovene om generel kemi finder anvendelse på begge forbindelser, berettiger forskellige årsager og gør denne opdeling nødvendig. Således adskiller organiske og uorganiske forbindelser sig i forskellige egenskaber, såsom: deres Opløselighed foretrukket i organiske opløsningsmidler (ether, alkohol, chloroform osv.) og i henholdsvis vand Stabilitet (organiske forbindelser nedbrydes ved relativt lave temperaturer) og Reaktionernes art; for uorganiske forbindelser er de ioniske, enkle og praktisk talt øjeblikkelige, og for organiske forbindelser er de kovalente, komplekse og langsomme.
Organiske forbindelser
Kulstofforbindelser med kæder på op til halvfems atomer er kendt. Det kæder Kulstofatomer kan være lineær og forgrenet og har enkelt kovalente bindinger eller har dobbelt eller tredobbelt binding. Mere end 2.500 forbindelser er kendt for kun at indeholde kulstof og brint (Kulbrinter).
Isomerisme af organiske forbindelser
I uorganiske forbindelser repræsenterer en formel generelt en enkelt forbindelse; der er således kun et stof med formlen H2SW4. Svovlsyre-molekylet indeholder to hydrogenatomer, et af svovl og fire af ilt, i et specifikt og unikt arrangement. I organiske forbindelser er det sjældent for at dette sker. Således er der for eksempel to forbindelser, der reagerer på formlen C2H6Eller Ethylalkohol eller Ethanol og Dimethylether.

Jo mere komplekst molekylet er, jo større er antallet af carbonatomer, jo større er antallet af mulige isomerer.
Organisk sammensat analyse
Analysen af en organisk forbindelse omfatter kvalitativ analyse, det kvantitativ analyse og Funktionel analyse. I tilfælde af at antage, at forbindelsen er i uren tilstand, renses den tidligere med Krystallisering, Destillation, Sublimering, Udvinding, etc. Renhedskriteriet kan bedømmes ud fra dets fysiske konstanter, såsom smeltepunkt, kogepunkt, densitet, opløselighed, krystallinsk form, brydningsindeks osv.
Det kvalitativ analyse Det verificeres ved at undersøge tilstedeværelsen af de elementer, der udgør forbindelsen, især kulstof, brint og kvælstof og undertiden halogener, svovl og fosfor.
Det kvantitativ analyse Det udføres ved hjælp af de metoder, der anvendes til kvalitativ analyse. Udgangspunktet er en bestemt mængde stof, der gennemgår forbrænding, og kuldioxid opsamles og vejes. dannet kulstof og vanddamp for at beregne procentdelen af kulstof og brint i forbindelse. Resultaterne af den kvantitative analyse letter beregningen af empirisk formel, selvom molekylformlen kun kan findes efter bestemmelsen af stoffets molekylvægt. Men problemet er endnu ikke løst, fordi den samme molekylære formel kan svare til forskellige isomerer.
Klassificering af organiske forbindelser
I henhold til deres struktur er organiske forbindelser opdelt i forbindelser alifatisk, aromatisk Y heterocyklisk. Alifatiske forbindelser er relateret til methan CH4, er åbne kæder bortset fra cycloparaffiner og skylder deres navn det faktum, at animalske og vegetabilske fedtstoffer hører til denne gruppe.
Det aromatiske forbindelser, lukket kæde, tæt beslægtet med benzen, C6H6, og de skylder deres navn det faktum, at mange af dem har duftende, behagelige lugte.
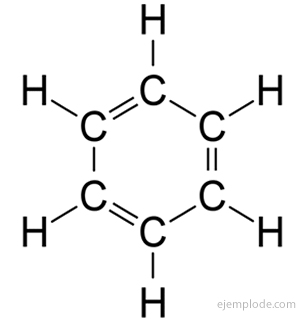
Benzenring
Det heterocykliske forbindelser De er lukkede forbindelser, hvis ring indeholder et andet grundstof end kulstof.
På grund af deres forfatning er de:
Kulbrinter, der igen klassificeres som på grund af den type links det har Alkaner, Alkenes Y Alkynes. Derudover er cycloalkaner, benzen og deres derivater, der kun består af kulstof og brint, i denne kategori.
Heterocykliske forbindelser
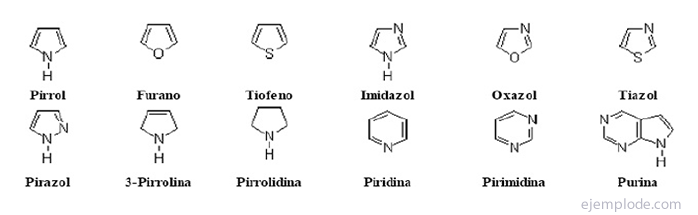
Halogenerede derivater:R-X
Nitrocompounds:R-NO2
Sulfonsyrer:R-SO3H
Nitriler (ELLER alkylcyanider) og Isonitriler:R-CN og R-NC. De adskiller sig i, hvordan kvælstofatomet er bundet i molekylet.
Alkoholer:R-OH
Phenoler: Forbindelser baseret på en rygrad, der består af en benzenring med en tilsat hydroxylgruppe.

Ethers:R-O-R
Mercaptans: R-SH
Thioethers:R-S-R
Thiosyrer:R-COSH
Aldehyder:R-CHO
Ketoner:R-CO-R
Carboxylsyrer:R-COOH
Du går ud:R-COOM (M til metal)
Estere: R-COO-R
Anhydrider: R-CO-O-OC-R
Aminer:R-NH2, R-NH-R, 2R-N-R
Aldosa type kulhydrater:-CHOH-CHOH-CHO
Ketose-type kulhydrater:-CHOH-CO-CH2Åh
Organometalliske forbindelser:R-M-R
Metalalkylhalogenider:R-MX (også kendt som Grignard Reagents)