Eksempel på nomenklatur for organiske forbindelser
Kemi / / July 04, 2021
Organiske forbindelser er molekyler, hvis egenskab er, at de dannes af en base af kulmolekyler og brint, også kendt som skelet, og kombineret med andre grundstoffer, hovedsageligt ilt, nitrogen og svovl.
Det IUPAC (International Union of Pure and Applied Chemistry, International Union of Pure and Applied Chemistry) har etableret generelle regler for klassificering og nomenklatur for organiske molekyler, hvoraf vi forklarer de vigtigste.
Kulbrinter
Kulbrinter er de enkleste organiske molekyler, der består af et carbonskelet og hydrogenatomer. Der er tre typer kulbrinter:
Alkaner
De er de enkleste, dannet af kulstofatomer forbundet med enkle kovalente bindinger til atomerne i hydrogen, med den generelle formulering H = 2n + 2, dvs. hydrogenatomer er dobbelt så mange som hydrogenatomer. kulstof plus 2. Dens nomenklatur er dannet med de numeriske præfikser met- for 1 carbonatom, et- for 2, prop- for 3 og but- for 4; fra 5 carbonatomer anvendes de almindelige præfikser pent-, hex-, hept-, oct- osv. Til alle alkaner tilføjes slutningen -ano.
Eksempel: CH4: methan; C2H6: etan; C4H10: butan; C6H14: hexan
Alkenes
De er dannet af et kulstofskelet, hvor der er en dobbeltbinding mellem kulstofatomer. Dens generelle formel er H = 2n, det vil sige, at dens hydrogenatomer er dobbelt så mange carbonatomer. Ligesom alkaner bruger de præfikser, der angiver deres antal kulstofatomer, og i dette tilfælde tilføjes slutningen -eno. Derudover i molekyler med mere end tre carbonatomer kulstof, hvor dobbeltbindingen findes, begyndende at tælle fra det kulstof, der er tættest på er.
Eksempler: C2H4: ethene; C3H6: propen; C4H8: buten, 2-buten; C6H12: Hexen, 2-hexen (dobbeltbinding ved atom 2), 3-hexen (dobbeltbinding ved atom 3).
Alkynes
Alkyner indeholder en tredobbelt binding ved deres kulstofatomer. Dens generelle formel er H = 2n-2, hvilket indikerer, at molekylet vil indeholde to hydrogenatomer mindre end dobbelt så mange carbonatomer. Til præfikset, der angiver antallet af carbonatomer, tilføjes slutningen -ino. Som i tilfældet med alkener nævnes carbon, der indeholder den tredobbelte binding, talt fra det yderste tættest på det.
Eksempler: C2H2: ethyne; C3H4: tip; C4H6: butyne, 2-butyne; C6H12: Hexino, 2-hexen (tredobbelt binding ved atom 2), 3-hexyne (tredobbelt binding ved atom 3).
Funktionelle grupper
Funktionelle grupper er kombinationer af atomer, der fungerer som en ion og erstatter et hydrogenatom i formlen af en alkan.
Radikaler
Alkanen uden hydrogenatom kaldes Radical, og for at identificere det tilføjes slutningen -ilo:
Eksempler CH4: methan - CH3+ methyl; C2H6: etan - C2H5+ ethyl; C4H10: butan - C4H9+ butyl; C6H14: hexan - C6H13+ hexyl.
Kombination af kulbrinter
En af de tilfælde, der kan forekomme, er at to eller flere carbonhydrider kombineres i et molekyle. Kulbrinterne, som det kombineres med, kaldes arborescenser. I disse tilfælde vil det basiske carbonhydrid være det med den længste kæde, og antallet af kulstof hvor arborescenserne findes efterfulgt af navnet på radikalen med slutningen -il og derefter navnet på carbonhydridet grundlag. Nummeret vil blive nævnt så mange gange som træerne der er knyttet til det. I tilfælde af at arborescenserne er af samme radikal i forskellige kulstofatomer, vil antallet adskilt af komma blive nævnt efterfulgt af en bindestreg, navnet på radikalen, derefter antallet af atomer, hvor den anden radikal er bundet, hvis nogen, et bindestreg, navnet på radikalet og navnet på carbonhydridet grundlag. Hvis der er to radikaler knyttet til det samme carbonatom, vil antallet blive nævnt to gange. Hvis de er forskellige radikaler, vil det blive nævnt en gang før navnet på hver radikal; hvis radikaler er ens, vil antallet blive nævnt to gange. Vi starter med at nævne de enkleste arborescenser først (dem med mindst mulig kulstof) og derefter dem med den højeste mængde.
Eksempel: Et pentanmolekyle med to etanradikaler, bundet til carbon 2 og 3:
2,3-ethylpentan. Et octanmolekyle, en propanradikal ved carbon 6, methanradikaler ved carbonatomer 4 og 5 og ethanradikaler, bundet til carbonatomer 2, 3 og 4: 4,5-methyl-2,3,4-ethyl-6- propyl -oktan.
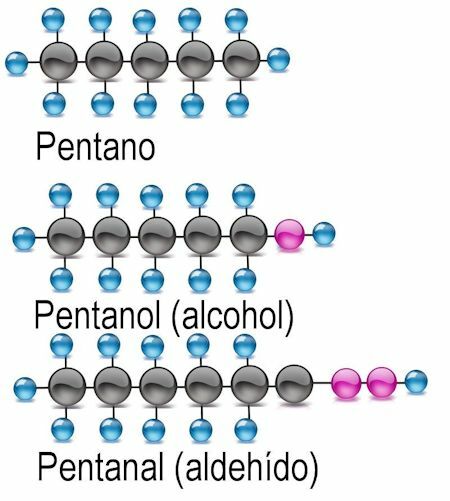
Alkohol funktionel gruppe
Den enkleste af de funktionelle grupper er alkohol, hvor et hydrogenatom erstattes af en hydroxylgruppe (OH). I disse forbindelser tilsættes slutningen -anol til navnet på gruppen. Hvor det er relevant, skal det carbonatom, hvor den funktionelle gruppe findes, nævnes:
Eksempler CH3OH: methanol: C2H5OH ethanol; C4H9OH butanol eller 2-butanol; C6H13OH-hexanol, 2-hexanol (funktionel gruppe ved atom 2), 3-hexanol (funktionel gruppe ved atom 3).
Aldehyd funktionel gruppe
I aldehyder udskiftes hydrogenatomet med den funktionelle gruppe -CHO. For at identificere dem tilføjes slutningen -anal, og carbonatomet, hvor den funktionelle gruppe findes, nævnes også:
Eksempler CH3COH: methanal: C2H5Ethanal COH; C4H9COH butanal eller 2-butanal; C6H13COH-hexanal, 2-hexanal (funktionel gruppe ved atom 2), 3-hexanal (funktionel gruppe ved atom 3).
Syre funktionel gruppe
I organiske syrer udskiftes hydrogenatomet med den funktionelle gruppe -COOH. For at identificere dem nævnes ordet syre, og slutningen -anoic tilføjes, og carbonatomet, hvor den funktionelle gruppe findes, nævnes også:
Eksempler CH3COOH: methansyre: C2H5COOH ethansyre; C4H9COOH butansyre eller 2-butansyre; C6H13COH-hexansyre, 2-hexansyre (funktionel gruppe ved atom 2), 3-hexansyre (funktionel gruppe ved atom 3).


