10 Beispiele für Gasgemische
Verschiedenes / / July 04, 2021
Mischungen von gasförmige Stoffe Sie gehören zu den am einfachsten zu erreichenden, da es sehr gut möglich ist, dass Stoffe, die sich in diesem Aggregatzustand befinden, vermischt werden. Beispielsweise: Neon-, Argon- und Xenon-Gemisch, Aerosol-Insektizid, Luft und Helium.
Praktisch alle Gase sind unbegrenzt kombinierbar, natürlich bedingt durch einige chemischer, physikalischer und grundsätzlich mit Anwendersicherheitsaspekten verbundener manipuliert. Wie die verschiedenen Arten von Gemischen, die zwischen Stoffen hergestellt werden, sind Gemische von Gase sie haben auch Eigenschaften, die für sie einzigartig sind.
Das Studium der kohlensäurehaltige Mischungen ist in der Regel genauso nützlich wie das von Gasen im reinen Zustand: das gleiche Wissen über die Luft, die in die Atmosphäre wäre ohne das Wissen um die Anteile und das Verhalten von Mischgasen unmöglich.
Auf diese Weise ist es wichtig, einige zu wissen Eigenschaften von Gasgemischen, wie die Eigenschaft des Partialdrucks (der von jedem der Gase innerhalb des Gases ausgeübt wird) Mischung) und die des molaren Anteils (Verhältnis der Molzahl einer gasförmigen Komponente zu der der Gesamtmischung) Sprudel). Die Mole drücken die Gasmenge in der Mischung aus.
Das Daltons Gesetz besagt, dass der Gesamtdruck eines Gasgemisches gleich der Summe der Partialdrücke von jedem ist eines der einzelnen Gase, die daran teilnehmen (vorausgesetzt, die Gase reagieren nicht zwischen Ja). Unter Partialdruck wird hier der Druck verstanden, den jedes der Gase ausüben würde, wenn es sich nur im gleichen Behälter und unter den gleichen Bedingungen von Temperatur. A) Ja:
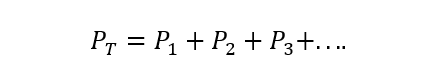
Wo PT ist der Gesamtdruck und P1, P2 Und P3 sind die Partialdrücke der hypothetischen Gase 1, 2 und 3 im Gasgemisch.
Unter Verwendung des Daltonschen Gesetzes wurde ein Ausdruck entwickelt, um die Partialdruck eines Gases in einem Gasgemisch, wenn wir seinen Gesamtdruck und seinen Stoffmengenanteil kennen.
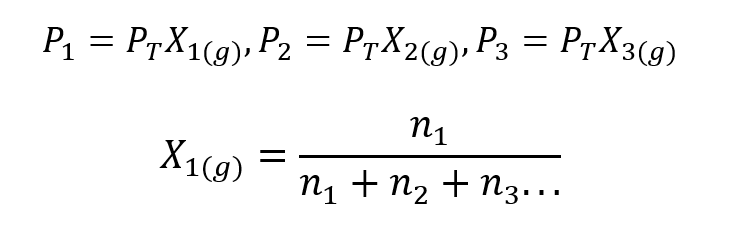
Wo X1, X2 Ja X3 sind die Stoffmengenanteile der hypothetischen Gase 1, 2 und 3 im Gasgemisch und nein1, nein2 Ja nein3 sind die Stoffmengen jedes dieser Gase im gleichen Gemisch.
Einer der Haupteigenschaften der Komponenten in Mischungen ist die Konzentration, die in verschiedenen Einheiten angegeben werden kann. Bei Gasgemischen kann die Konzentration seiner Bestandteile in ppm (parts per million) angegeben werden, einer Einheit bezogen auf das Volumen. Das heißt, eine bestimmte Menge an ppm einer Komponente in einer Gasmischung ist das Verhältnis des Volumens dieser bestimmten Menge zum Volumen jeder Million Einheiten der Mischung.
Es ist wichtig sich das zu merken ppm eines Gases hängen von der Temperatur und dem Druck des Gases ab. Aus diesem Grund werden zur Berechnung der ppm eines Gases normalerweise normale Druck- und Temperaturbedingungen verwendet. (CNPT), die einen Normalzustand bei 0 Grad Celsius Temperatur und 1013 Hektopascal (1 bar) von Druck. Wenn diese Bedingungen nicht verwendet werden, müssen Sie angeben, welche verwendet werden.
Es kann Ihnen dienen:
Beispiele für Gasgemische
Die folgende Liste enthält Gasgemische mit Angabe der Elemente, die in dem Gemisch vorkommen:
- Luft (Gemisch aus 21 % Sauerstoff und 79 % Stickstoff, plus andere Gase in geringen Anteilen)
- Cronigón (Mischung aus 99% Argon und 1% Sauerstoff)
- Trimix (Gemisch aus Sauerstoff, Stickstoff und Helium)
- Neon-, Argon- und Xenon-Mix
- Mischung aus 85 % Methan, 9 % Ethan, 4 % Propan und 2 % Butan.
- Schwefelhexafluorid und Luft
- Aerosol-Insektizid
- Luft und Helium
- Nitrox (Luftgemisch, angereichert mit Sauerstoff und Stickstoff)
Folge mit:
