Wie entstehen Säuren, Basen und Salze?
Verschiedenes / / July 04, 2021
Es gibt mehrere Theorien, um die define Säuren und der Basen, darunter der Arrhenius, der Brönsted-Lowry und der Lewis.
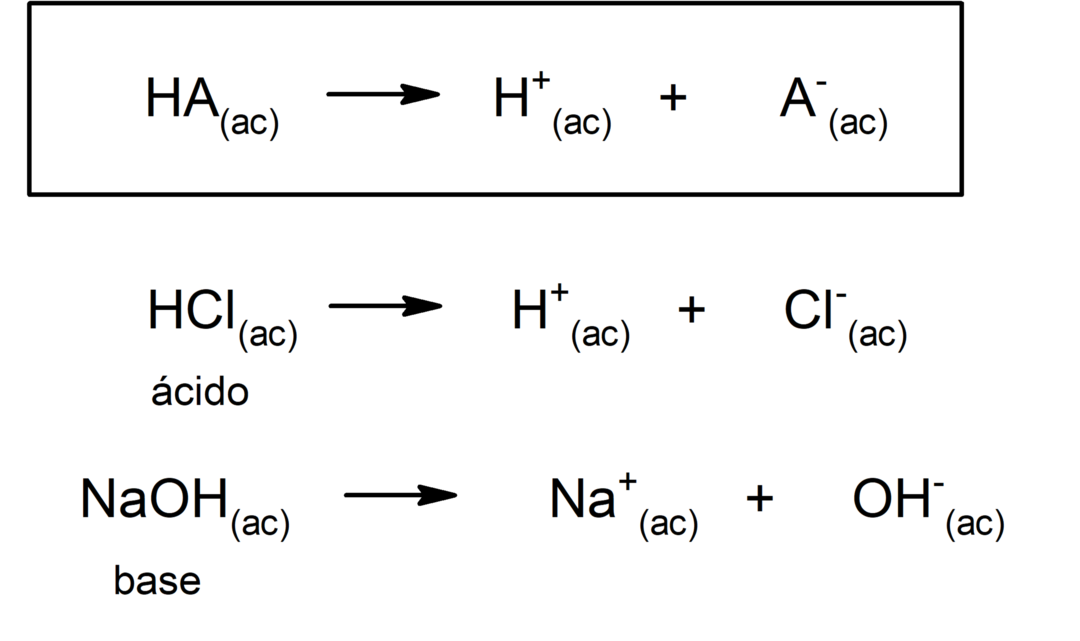
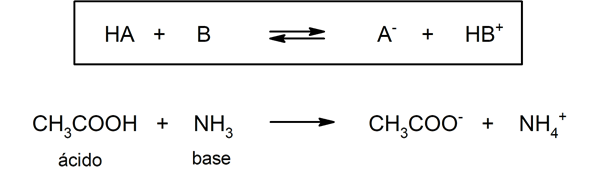
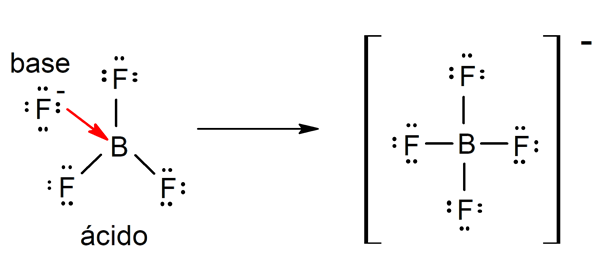
Typ Säuren Oxsäuren werden normalerweise gebildet von formed Reaktion zwischen einem nichtmetallischen Oxid mit Wasser, während Säuren vom Typ Säuren werden gebildet durch die Kombination von a Nichtmetall mit Wasserstoff in wässriger Lösung. Beispielsweise:Schwefelsäure (H2SW4) es ist eine Oxsäure und Salzsäure (HCl(ac)) es ist ein Wassersäure.
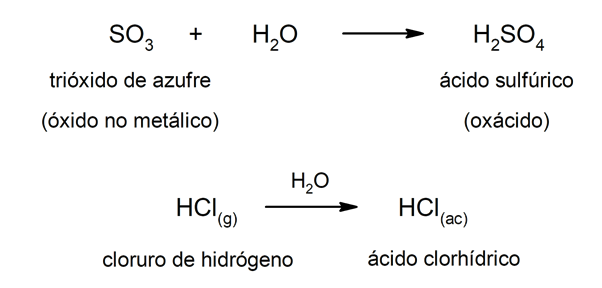
Andererseits können Basen durch die Reaktion zwischen a Metalloxid Und das Wasser. Beispielsweise: Magnesiumhydroxid (Mg (OH)2).
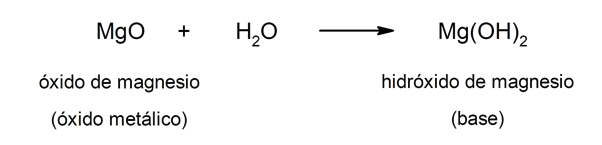
Allgemeine Eigenschaften von Säuren und Basen
Im Allgemeinen sind Säuren sauer und ätzend. Die Basen sind auch ätzend, bitter im Geschmack, ätzend bei Berührung mit der Haut und hat einen seifigen Touch. Andererseits haben saure Lösungen a pH weniger als 7, während basische Lösungen einen pH-Wert von mehr als 7 haben.
Säure- und Basenstärke
Das Neigung einer Säure zu dissoziieren und den pH-Wert zu senken, wird oft als "Säurestärke" bezeichnet. Eine Säure ist stark, wenn sie in wässriger Lösung vollständig dissoziieren kann, und schwach, wenn ihre Dissoziation teilweise erfolgt. Beispiele für starke Säuren sind Perchlorsäure (HClO
4), Schwefelsäure (H2SW4), Iodwasserstoff (HI), Bromwasserstoff (HBr), Salzsäure (HCl) und Salpetersäure (HNO3). Essigsäure (CH3COOH), Zitrus (C6H8ODER7) und Benzoesäure (C6H5COOH) sind schwach.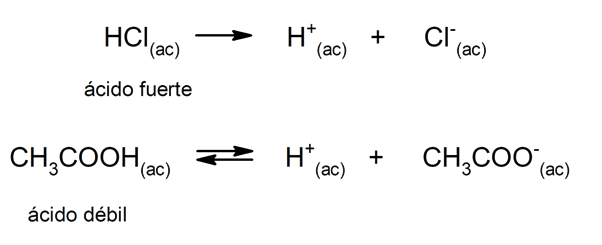
Ebenso können sie betrachtet werden als considered starke basis solche, die in wässriger Lösung vollständig dissoziieren, und schwach, wenn ihre Dissoziation teilweise erfolgt. Beispiele für starke Basen sind Kaliumhydroxid (KOH), Natrium (NaOH), Lithium (LiOH) und Magnesium (Mg (OH)2). Auf der anderen Seite Ammoniak (NH3) ist eine schwache Basis.
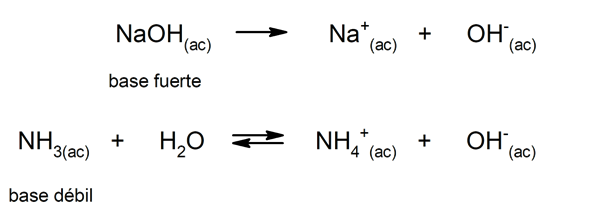
Wie entstehen Salze?
Das du gehst raus sind ionische Verbindungen unterschiedlicher Komplexität, kommen in der Natur vor und werden im Allgemeinen gebildet durch die Kombination von Säuren mit Basen in einer Neutralisationsreaktion, die eine Freisetzung von Wasser. Sie können auch als Ergebnis der Reaktion zwischen einem Metall und einer Säure, einem Metall und einem Nichtmetall oder der Reaktion zwischen verschiedenen Salzen gebildet werden.
Die Salze lassen sich einteilen in:
Verbreitung und Bedeutung
Säuren sind sehr wichtig sowohl in Industrie wie in der Natur. Salzsäure ist zum Beispiel Teil unseres Verdauungssystems und wird benötigt, um die enthaltenen Nährstoffe abzubauen Lebensmittel. Desoxyribonukleinsäure, besser bekannt als DNA, bildet die Chromosomen, in denen die genetische Information kodiert wird, die für ihre Kodierung erforderlich ist. Lebewesen vermehren und entwickeln. Borsäure ist ein wichtiger Bestandteil in der Glasindustrie.
Das Kalziumkarbonat Es ist ein sehr häufiges Salz in verschiedenen Arten von Kalksteinfelsen. Durch hohen Anteil Temperaturen (900°C) aus Calciumcarbonat, Calciumoxid oder Branntkalk gewonnen wird. Die Zugabe von Wasser zu Branntkalk erzeugt Calciumhydroxid, den sogenannten Löschkalk, der eine Base ist. Diese Materialien Sie werden im Bauwesen verwendet.
Folge mit:


