Wie entstehen Hydroxide? (mit Beispielen)
Verschiedenes / / July 04, 2021
Das Hydroxide resultieren aus der Kombination von a Metalloxid (auch genannt basische Oxide) Und das Wasser. Auf diese Weise ist die Zusammensetzung der Hydroxide gegeben durch drei Elemente: Sauerstoff, Wasserstoff und das betreffende Metall. In Kombination die Metall tue immer so Kation und die Hydroxidgruppe (OH–) wirkt als Anion. Beispielsweise:
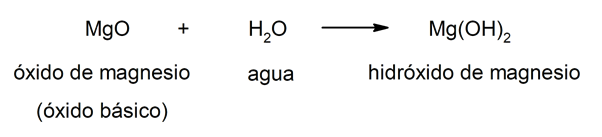
Hydroxide im Allgemeinen teilen eine Reihe von Eigenschaften, wie einen bitteren Geschmack und eine ätzende Wirkung. Darüber hinaus sind sie in der Regel rutschig und korrosiv. Andererseits haben sie einige Eigenschaften von Waschmitteln und Seifen. Die meisten sind wasserlöslich und reagieren mit Säuren produzieren du gehst raus.
Andererseits sind einige Eigenschaften für jede Art von Hydroxid spezifisch, wie z Natrium (NaOH), das Wasser aufnimmt, und mit Branntkalk (CaO) vermischt, absorbiert schnell Kohlendioxid (CO2). Für seinen Teil, Calciumhydroxid (Ca (OH)2) es wird bei der Reaktion von Calciumoxid mit Wasser gewonnen und absorbiert auch CO
2. Ein weiteres Beispiel ist die Eisen (II) Hydroxid (Fe (OH)2), das eine gelatinöse Verbindung ist und in Wasser praktisch unlöslich ist.Hydroxide werden auch genannt Basen oder Laugen, obwohl diese Begriffe auch für andere Stoffe mit alkalischem Charakter, die keine Hydroxide sind, erweitert wurden.
Wofür werden Hydroxide verwendet?
Auch die Anwendungen von Hydroxiden variieren zwischen den verschiedenen Fällen:
Nomenklaturen
Neben anderen Arten von Chemische Komponenten, gibt es verschiedene Nomenklaturen für Hydroxide:
Beispiele für Hydroxide
- Blei(II)-hydroxid, Pb (OH)2, Bleidihydroxid.
- Platin(IV)-hydroxid, Pt (OH)4, Platintetrahydroxid.
- Vanadisches Hydroxid, V (OH)4, Vanadiumtetrahydroxid.
- Eisenhydroxid, Fe (OH)2, Eisenhydroxid.
- Blei(IV)-hydroxid, Pb (OH)4, Bleitetrahydroxid.
- Silberhydroxid, AgOH, Silberhydroxid.
- Kobalthydroxid, Co (OH)2, Kobaltdihydroxid.
- Manganhydroxid, Mn (OH)3, Mangantrihydroxid.
- Eisenhydroxid, Fe (OH)3, Eisentrihydroxid.
- Kupferhydroxid, Cu (OH)2, Kupferdihydroxid.
- Aluminiumhydroxid, Al (OH)3, Aluminiumtrihydroxid.
- Natriumhydroxid, NaOH, Natriumhydroxid.
- Strontiumhydroxid, Sr (OH)2, Strontiumdihydroxid.
- Magnesiumhydroxid, Mg (OH)2, Magnesiumdihydroxid.
- Ammoniumhydroxid, NH4OH, Ammoniumhydroxid.
- Cadmiumhydroxid, Cd (OH)2, Cadmiumdihydroxid.
- Vanadisches Hydroxid, V (OH)3, Vanadiumtrihydroxid.
- Quecksilberhydroxid, Hg (OH)2, Quecksilberdihydroxid.
- Kupfer(I)-hydroxid, CuOH, Kupferhydroxid.
- Lithiumhydroxid, LiOH, Lithiumhydroxid.
Hydroxide haben manchmal gebräuchliche Namen gegeben durch seine konventionelleren Anwendungen: Natriumhydroxid wird auch Natronlauge genannt, Kaliumhydroxid wird genannt Ätzkali, Calciumhydroxid, das als Kalkwasser oder gelöschter Kalk bezeichnet wird, und Magnesiumhydroxid, das als Milch von Magnesia.
Folge mit:



