20 Beispiele für saure Salze
Verschiedenes / / July 04, 2021
In dem Anorganische Chemie Salze werden Verbindungen genannt, die erhalten werden, wenn a Acid seine Wasserstoffatome werden durch metallische Kationen ersetzt (obwohl manchmal durch nichtmetallische Kationen, zum Beispiel das Ammoniumkation, NH4+). Im konkreten Fall von saure Salze, die Wasserstoffe der Säure teilweise substituiert sind, dh mindestens ein unsubstituierter Wasserstoff verbleibt als Teil des Salzes. Darin unterscheiden sie sich von neutrale Salze, wobei die Wasserstoffe der Säure vollständig substituiert sind.
Das du gehst raus entstehen normalerweise durch die Reaktion zwischen a Acid und ein Hydroxid (Base). Bei diesen Reaktionen verliert normalerweise die Base ihre Hydroxylgruppen (-OH) und die Säure sie. Atome Wasserstoff (H), der ein neutrales Salz bildet; aber wenn die betreffende Säure mindestens eines ihrer Wasserstoffatome erhält, wodurch die elektrische Ladung der Reaktion verändert wird, erhalten wir ein saures Salz oder ein hydriertes Salz.
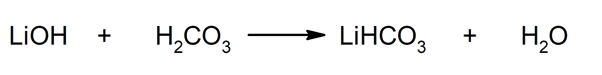
So werden beispielsweise Lithiumbicarbonat und Wasser aus der Reaktion von Lithiumhydroxid und Kohlensäure gewonnen:
Nomenklatur der Säuresalze
Saure Salze können benannt werden nach drei Arten gängigste Nomenklatur:
Beispiele für Säuresalze
- Natriumbicarbonat (NaHCO3). Es wird auch Natriumhydrogencarbonat (IV) genannt und ist ein weißer kristalliner Feststoff, der in Wasser löslich ist und in der Natur im Staat vorkommt Mineral oder es kann im Labor hergestellt werden. Es ist eines der bekanntesten Säuresalze und wird häufig in der Süßwaren-, Pharmakologie- oder Joghurtherstellung verwendet.
- Lithiumbicarbonat (LiHCO3). Dieses Säuresalz wurde als Einfangmittel für CO. verwendet2 in Situationen, in denen ein solches Gas unerwünscht ist, wie bei den nordamerikanischen "Apollo"-Weltraummissionen.
- Kaliumdihydrogenphosphat (KH2Bestellung4). Es ist ein kristalliner Feststoff, geruchlos, wasserlöslich, weit verbreitet in verschiedenen Industrien wie Hefe von Lebensmittel, Chelatbildner, Nahrungsverstärker und Helfer bei den Fermentationsprozessen.
- Natriumbisulfat (NaHSO4). Es ist ein saures Salz, das durch die Neutralisation von Schwefelsäure entsteht. Es wird industriell häufig bei der Raffination von Metallen und Reinigungsmitteln verwendet. Obwohl es für einige Stachelhäuter hochgiftig ist, wird es als Zusatzstoff in Tiernahrung und bei der Herstellung von Schmuck verwendet.
- Natriumhydrogensulfid (NaHS). Der Umgang mit dieser Verbindung ist gefährlich, da sie stark ätzend und giftig ist. Es kann schwere Hautverbrennungen und Augenschäden verursachen, da es auch brennbar ist.
- Calciumhydrogenphosphat (CaHPO4). Es wird als Nahrungsergänzungsmittel in verwendet Getreide für Rinder. Es ist ein in Wasser unlöslicher Feststoff, der jedoch kristallisieren kann, wenn er durch den Verzehr von zwei hydratisiert wird Moleküle aus Wasser.
- Ammoniumhydrogencarbonat ([NH4] HCO3). Auch als "Ammoniumbicarbonat" bekannt, wird es in der Lebensmittelindustrie als Hefe verwendet chemisch, obwohl es den Nachteil hat, dass es Ammoniak einfängt und den Lebensmitteln einen schlechten Geschmack verleiht, wenn es in. verwendet wird Überschuss. Es wird auch in Feuerlöschern, zur Pigmentherstellung und zum Expandieren von Gummi verwendet.
- Bari-Bikarbonatoder (Ba [HCO3]2). Es ist ein saures Salz, das beim Erhitzen seine Produktionsreaktion umkehren kann und außer in Lösung sehr instabil ist. Es wird häufig in der Keramikindustrie verwendet.
- Natriumbisulfit (NaHSO3). Dieses Salz ist extrem instabil und wird in Gegenwart von Sauerstoff zu Natriumsulfat (Na2SW4), weshalb es in der Lebensmittelindustrie als Konservierungs- und Trockenmittel für Lebensmittel verwendet wird. Es ist ein extremes Reduktionsmittel und wird häufig von Menschen verwendet, auch zum Fixieren von Farben.
- Calciumcitrat (AC3[C6H5ODER7]2). Allgemein als Bittersalz bekannt, wird es als Konservierungsmittel für Lebensmittel und als Nahrungsergänzungsmittel verwendet, wenn es mit der Aminosäure Lysin verbunden ist. Es ist ein weißes, geruchloses, kristallines Pulver.
- Monocalciumphosphat (Ca [H2Bestellung4]2). Es ist ein farbloser Feststoff, der aus der Reaktion von Calciumhydroxid und Phosphorsäure gewonnen wird und häufig als Treibmittel oder als Dünger in der Landwirtschaft verwendet wird.
- Dicalciumphosphat (CaHPO4). Auch als Calciummonohydrogenphosphat bekannt, hat es drei verschiedene kristalline Formen, die als Zusatz in Lebensmitteln verwendet werden und in Zahnpasten enthalten sind. Außerdem wird es auf natürliche Weise in Nierensteinen und im sogenannten „Nierenstein“ gebildet.
- Monomagnesiumphosphat (MgH4P2ODER8). Es ist ein weißes, kristallines und geruchloses Salz, das teilweise in Wasser löslich ist. Es wird bei der Konservierung von Lebensmitteln, als Säuerungsmittel, als Säurekorrektor oder Mittel bei der Behandlung von Mehle.
- Natriumdiacetat (NaH [C2H3ODER2]2). Dieses Salz wird als Geschmacks- und Konservierungsstoff in Speisen verwendet, wodurch das Auftreten von verhindert oder verzögert wird Pilze und Mykobakterien, sowohl in vakuumverpackten Produkten wie Fleischprodukten als auch in der Mehlindustrie.
- Calciumbicarbonat (Ca [HCO3]2). Es ist ein hydriertes Salz, das aus Kalziumkarbonat stammt und in Mineralien wie Kalkstein, Marmor und anderen enthalten ist. Diese Reaktion beinhaltet die Anwesenheit von Wasser und CO2, so dass es in Höhlen und kalziumreichen Höhlen spontan auftreten kann.
- Rubidiumsäurefluorid (RbHF). Dieses Salz wird aus der Reaktion von Flusssäure (Wasserstoff und Fluor) und Rubidium, einem Alkalimetall, gewonnen. Das Ergebnis ist eine giftige und korrosive Verbindung, die mit Vorsicht gehandhabt werden muss.
- Monoammoniumphosphat ([NH4] H2Bestellung4). Es ist ein wasserlösliches Salz, das durch die Reaktion von Ammoniak und Phosphorsäure entsteht. Es wird normalerweise als Dünger verwendet, da es dem Boden die Nährstoffe Stickstoff und Phosphor, die für das Pflanzenwachstum notwendig sind. Es ist auch Bestandteil des ABC-Pulvers in Feuerlöschern.
- Zinkhydrogenorthoborat (Zn [HBO3]). Es ist ein Salz, das als Antiseptikum und als Zusatzstoff bei der Herstellung von Keramik verwendet wird.
- Mononatriumphosphat (NaH2Bestellung4). Es wird hauptsächlich in Labors als "Puffer" oder Pufferlösung verwendet, die plötzliche pH-Änderungen einer Lösung verhindert.
- Kaliumhydrogenphthalat (KHP). Auch „Kaliumsäurephthalat“ genannt, ist es ein festes und stabiles Salz in normaler Luft, weshalb es oft als Primärstandard bei Messungen von pH. Es ist auch als Puffermittel in chemische Reaktionen.
Folge mit:


