20 Beispiele für Alkane
Verschiedenes / / July 04, 2021
Das alkane sie sind eine art von Kohlenwasserstoffe in denen eine variable Anzahl von Kohlenstoffatomen durch Einfachbindungen wie ein Gerüst miteinander verbunden sind, und jedes Kohlenstoffatom ist wiederum an Wasserstoffatome gebunden, die schließlich durch andere ersetzt werden können Atome oder Funktionsgruppen. Beispielsweise: Chloroform, Methan, Oktan.
Das Molekularformel der offenen linearkettigen Alkane ist CnH2n + 2, wobei C für Kohlenstoff steht, H für Wasserstoff steht und n für die Anzahl der Kohlenstoffatome steht. Alkane sind gesättigte Kohlenwasserstoffe, das heißt sie haben keine Doppel- oder Dreifachbindungen. Um sie zu benennen, verwenden Sie die Suffix "-Ano" nach der Benennung der Kohlenstoffkette mit dem Präfix entsprechend der Anzahl der Kohlenstoffatome (et- (2), pro- (3), but- (4), pen- (5), hex- (6), hep- (7) usw.).
Es kann Ihnen dienen:
Klassifizierung von Alkanen
Innerhalb der Alkane werden sie meist erkannt zwei große Gruppen: offene Kette (auch azyklisch genannt) und geschlossene Kette (oder zyklisch).
Wenn der offenkettige Verbindungen Sie weisen keine Substitution der Wasserstoffe auf, die jedes Kohlenstoffatom begleiten, sie werden lineare Alkane genannt: Dies sind die einfachsten Alkane. Wenn sie eine oder mehrere ihrer Wasserstoffatome durch eine oder mehrere Kohlenstoffketten ersetzen, werden sie als verzweigte Alkane bezeichnet. Die häufigsten Substituenten sind Ethylgruppen (CH3CH2-) und Methyl (CH3-).
Es gibt ihrerseits Verbindungen mit einem einzigen Zyklus im Molekül (monozyklisch) und andere mit mehreren (polyzyklisch). Das zyklische Alkane sie können homozyklisch sein (sie werden unter ausschließlicher Einwirkung von Kohlenstoffatomen gebildet) oder heterozyklisch (an denen andere Atome beteiligt sind, zum Beispiel Sauerstoff oder Schwefel).
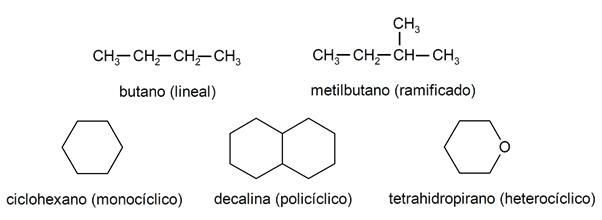
Physikalische Eigenschaften von Alkanen
Im Allgemeinen, physikalische Eigenschaften der Alkane werden durch die Molekülmasse (die wiederum mit der Länge der Kohlenstoffkette verbunden ist) konditioniert. Diejenigen mit der niedrigsten Kohlenstoffzahl sind gasförmig zu Temperatur Umgebung, solche mit 5 bis 18 Kohlenstoffatomen sind Flüssigkeiten, und über dieser Zahl stehen solide (ähnlich wie Wachs).
Da sie weniger dicht als Wasser sind, neigen sie dazu, darauf zu schwimmen. Im Allgemeinen sind Alkane in Wasser unlöslich und in organischen Lösungsmitteln löslich.
Der Punkt von Sieden und von Verschmelzung der Alkane hängt von ihrer molekulare Masse, also von der Länge der Kohlenstoffkette, hängen aber auch vielfach von der räumlichen Anordnung der Atome ab. Lineare und zyklische Alkane haben höhere Siedepunkte als verzweigte.
Chemische Eigenschaften von Alkanen
Alkane zeichnen sich dadurch aus, dass sie Chemische Komponenten von sehr schlechte Reaktionsfähigkeit, weshalb sie auch als "Paraffine" (lateinisch, parum affinis bedeutet "geringe Affinität"). Sie sind Verbindungen, die eine sehr hohe Aktivierungsenergie haben, wenn sie an chemische Reaktionen. Die wichtigste Reaktion, die Alkane eingehen können, ist Verbrennung in Gegenwart von Sauerstoff, Wärme, Kohlendioxid und Wasser erzeugen.
Alkane sind die Grundlage für eine Vielzahl von Reaktionen, die mit industrieller Prozess sehr wichtig, da es sich um die traditionellsten Brennstoffe handelt. Sie erscheinen auch als Endprodukte biologischer Prozesse wie der methanogenen Fermentation, die von einigen Mikroorganismen.
Beispiele für Alkane
Einige Beispiele für Alkane (einschließlich einiger bekannter linearer und verzweigter) sind:
- Chloroform (fantastischer Name des Trichlormethan; CHCl3). Dämpfe dieser Substanz wurden früher als Anästhetika verwendet. Es wurde zu diesem Zweck eingestellt, da es beschädigt wurde Organe wichtig, wie Leber oder Nieren. Seine Verwendung findet heute hauptsächlich als Lösungsmittel oder Kühlmittel statt.
- Methan (CH4). Es ist das einfachste Alkan von allen: Es besteht nur aus einem Kohlenstoffatom und vier Wasserstoffatomen. Es ist ein Gas, das natürlicherweise durch die Zersetzung verschiedener organischer Substrate entsteht und der Hauptbestandteil von Erdgas ist. In jüngster Zeit wurde es als eines der Gase anerkannt, das am meisten zum sogenannten Treibhauseffekt beiträgt.
- Oktan (C8H18). Es ist das Acht-Kohlenstoff-Alkan und von großer Bedeutung, da es die Endqualität des Naphthas bestimmt, die mischen verschiedener Kohlenwasserstoffe. Diese Qualität wird durch die Oktanzahl oder Oktanzahl des Kraftstoffs gemessen, die als Referenz einen schwach detonierenden (Index 100) und einen stark detonierenden (Index 0) verwendet.
- Hexan (C6H14). Es ist ein wichtiges Lösungsmittel, dessen Inhalation sollte vermieden werden, da es sehr giftig ist.
- Butan (C4H10). Zusammen mit Propan (C3H8) bilden die sogenannten Flüssiggase (LPG), die bei der Erdölförderung in Gassäcken entstehen. Derzeit wird der Ersatz von Benzin oder Diesel durch Flüssiggas als Kraftstoff gefördert, da es eines umweltfreundlicheren Kohlenwasserstoffs (er gibt bei seiner Verbrennung nur Kohlendioxid und Wasser ab).
- Icosano (C20H42). Es ist das Zwanzig-Kohlenstoff-Alkan (das Präfix 'ico' bedeutet zwanzig)
- Cyclopropan (C3H6). Früher wurde es als Anästhetikum verwendet
- n-Heptan (C7H16). Es ist dasjenige, das als Referenz für den Nullpunkt der Benzin-Oktanzahl verwendet wird, was am wenigsten wünschenswert wäre, da es explosionsartig brennt. Es wird aus dem Harz bestimmter. gewonnen Pflanzen.
- 3-Ethyl-2,3-dimethylpentan (C9H20)
- 2-Methylbutan (C5H12)
- 3-Chlor-4-n-propylheptan (C10H21Cl)
- 3,4,6-Trimethylheptan (C10H22)
- 1-Brom-2-phenylethan (C8H9Br)
- 3-Ethyl-4-methylhexan (C9H18)
- 5-Isopropyl-3-methylnonan (C13H28)
- Kubanisch (C8H8)
- 1-Brompropan (C3H7Br)
- 3-Methyl-5-n-propyloctan (C12H26)
- 5-n-Butyl-4,7-diethyldecan (C18H28)
- 3,3-Dimethyldecan (C12H26)

