Beispiel für chemische Basen
Chemie / / November 13, 2021
In der Allgemeinen Chemie, Basen sind eine Kategorie von Chemikalien die mehrere Funktionen erfüllen:
-Reagiere mit Säuren in einer Neutralisation, produziert ein Salz und Wasser.
-Regulierung des Wasserstoffpotentials, pH, was ihren Wert erhöht, wenn sie in die Mitte gegossen werden, wo eine Reaktion gefunden wird.
-Rennen wie Chemische Reagenzien für eine Vielzahl von Reaktionen.
Die Basen können verschiedene Arten sein, beide both Anorganische Chemie ab dem Organische Chemie, Wie Hydroxide, das Amine und der Alkohole, beispielsweise.
Um das Verhalten der Basen zu definieren, werden die drei wichtigsten Säure-Basen-Theorien verwendet: die von Arrhenius, die von Brönsted-Lowry und die von Lewis.
Die Basen nach Arrhenius
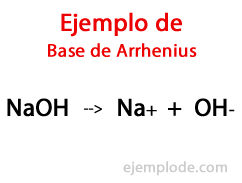
Nach Angaben des schwedischen Chemikers Svante Arrhenius, die Basen sind die chemischen Substanzen, die liefern Hydroxylionen (OH-) zu einem Reaktionsmedium, insbesondere wenn es sich um eine wässrige Lösung handelt. Somit gibt es mit den verfügbaren Hydroxylionen a Alkalischer pH-Wert, d. h. mit einem Wert von mehr als 7 und bis zu 14
abhängig davon, wie viel Base zum Zeitpunkt der Messung vorhanden ist.Dies ist eine der einfachsten und praktischsten anzuwendenden Theorien, da es keine Komplikationen gibt, die an der Reaktion beteiligten Substanzen zu unterscheiden. Es ist bekannt, welches die Säure und welches die Base ist.
Innerhalb dieser Theorie gibt es unbestreitbar anorganische Hydroxide, wie Natriumhydroxid (NaOH) und Kaliumhydroxid (KOH).
Die Basen nach Brönsted-Lowry
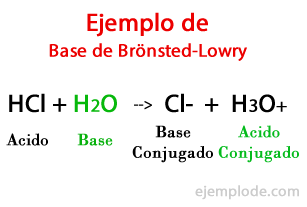
Nach der Theorie der dänischen Johannes Brönsted und die Briten Thomas Martin Lowry, eine Base ist eine chemische Spezies in der Lage, die Protonen aufzunehmen, die ein anderer, die Säure, abgeben wird während einer chemischen Reaktion. Das Proton hängt im Allgemeinen mit der positiven Ladung zusammen, die es kennzeichnet, sodass wir es wieder mit Wasserstoffionen (H +) assoziieren können.
Wenn der Austausch in der chemischen Reaktion stattfindet, die Produkte heißen: "Conjugated Acid Base" und "Conjugated Base Acid", basierend auf den Reaktanten, die sie gebildet haben.
Für diese Theorie, die Ammoniak (NH3) ist der repräsentativste Fall. Für Brönsted und Lowry sind die Substanzen, die Wasserstoffionen (H +) zurückhalten können, Basen. In diesem Fall nimmt das Ammoniak, indem es sich als Base verhält, einen Wasserstoff in seiner Struktur an und konsolidiert sich als Ammoniumion (NH4+), mit der überschüssigen positiven Ladung von Wasserstoff. Ammonium ist die konjugierte Säure von Ammoniak.
Amine, organische Verbindungen aus Ammoniak (NH3), wie Methylamin (CH3NH2), verhalten sie sich in Lösung wie Basen und können in ihrer Struktur positive Ladungen aufnehmen, entweder von Wasserstoff oder Carbokation.
Ein Carbokation ist ein organisches Ion, das als Kohlenwasserstoffkette gebildet wird, das in Abwesenheit eines negativen Ions, das Es kann das Hydroxyl (OH-) oder ein Halogen (Cl-, Br-) sein, es neigt dazu, an eine Stelle zu binden, die es aufnehmen kann, die die Base.
Die Basen nach Lewis
Der amerikanische Wissenschaftler Gilbert lewis wies in seiner Säure-Basen-Theorie darauf hin, dass die Basen sind diejenigen Substanzen, die ihre freien Elektronenpaare für eine andere beisteuern können, um ihr Oktett zu vervollständigen.
Diese Säure-Basen-Theorie ist eine Ergänzung zur Bestätigung der Gültigkeit ihrer Oktettregel, in der sie beschreibt, wie Atome erhalten Stabilität, indem sie in ihrer letzten Schale eine Anzahl von acht Elektronen erreichen, wobei die Bindungsfunktion verwendet wird Kovalent
Das Hydroxyl-Ion ist ein gutes Beispiel für eine Lewis-Base. Es hat ein Paar freier Elektronen, auf das ein Wasserstoffion, das keine Elektronen hat, gelangen kann. Es bildet sich ein Wassermolekül. Auf diese Weise wird das Oktett für den Sauerstoff des Moleküls gebildet, und die Wasserstoffe, die kleinere Atome sind, haben ihr Elektronenpaar, das sie stabil macht.

Verwendung wichtiger Basen
Das Natriumhydroxid NaOH Es wird im Allgemeinen in wässriger Lösung verwendet, um verfestigtes Fett in Haushalts- und Industrieöfen zu reinigen und es effektiv aufzulösen. Es wird auch in konzentrierter Lösung verwendet, wenn eine saure Substanz unvorhergesehen verschüttet wird, um sie zu neutralisieren.
Das Magnesiumhydroxid Mg (OH)2 Es wird in einer Lösung namens "Milch of Magnesia" verwendet, um Sodbrennen zu lösen und es zu neutralisieren. Es wird in Apotheken verkauft.
Das Kaliumhydroxid KOH Es wird als Reagens für Verseifungsprozesse verwendet und wandelt Fette in Seife um.
Das Ammoniak NH3 Es wird in gasförmiger Form als industrielles Kältemittel verwendet, insbesondere in Eisbereitern. Die Anwendung ist sehr gefährlich, da das Einatmen einer Konzentration von 5 Milligramm pro Liter davon in der Luft tödlich sein kann.
Beispiele für chemische Basen
Wasser H2ODER
Ammoniak NH3
Natriumhydroxid NaOH
Kaliumhydroxid KOH
Magnesiumhydroxid Mg (OH)2
Calciumhydroxid Ca (OH)2
Aluminiumhydroxid Al (OH)3
Ammoniumhydroxid NH4Oh
Eisenhydroxid Fe (OH)2
Eisen(III)-hydroxid Fe (OH)3
Hydroxylion (OH-)
Chloridion (Cl-)
Bromidion (Br-)


